Акромегалия: подходы к оптимизации медикаментозного лечения
И.А. Иловайская
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Для цитирования: Иловайская И.А. Акромегалия: подходы к оптимизации медикаментозного лечения // Эффективная фармакотерапия. 2021. Т. 17. № 13. С. 30–34.
DOI 10.33978/2307-3586-2021-17-13-30-34
Эффективная фармакотерапия. 2021.Том 17. № 13. Эндокринология
Акромегалия является хроническим заболеванием, которое часто требует длительного медикаментозного лечения.
Основной группой препаратов при акромегалии считаются аналоги соматостатина первого поколения – октреотид и ланреотид. Возможно также применение агониста дофаминовых рецепторов каберголина. С 2018 г. в России зарегистрирован еще антагонист гормона роста пэгвисомант.
Целью медикаментозной терапии признана нормализация уровня инсулиноподобного фактора роста 1, поэтому принципиально важно мониторировать этот показатель.
Если на фоне применения октреотида или ланреотида в максимальных дозах в течение 3–12 месяцев уровень инсулиноподобного фактора роста 1 не нормализуется, необходима оптимизация терапии.
В случае полной резистентности к аналогам соматостатина возможно переключение на пэгвисомант, а также активное нейрохирургическое и/или радиохирургическое вмешательство. При частичной резистентности оправданно назначение комбинированной терапии аналогами соматостатина и каберголином/пэгвисомантом.
В статье обсуждаются и обосновываются различные варианты оптимизации медикаментозного лечения акромегалии.
Введение
Акромегалия – хроническое заболевание, в основе патогенеза которого лежит гиперсекреция соматотропного гормона, или гормона роста (ГР), и ассоциированная с ней гиперпродукция инсулиноподобного фактора роста 1 (ИФР-1). В подавляющем большинстве случаев причиной акромегалии является опухоль гипофиза – соматотропинома [1, 2].
Длительный избыток ГР и ИФР-1 способствует многочисленным патологическим изменениям органов и тканей, что в свою очередь приводит к значительному ухудшению качества жизни и сокращению ее продолжительности [3].
Главными целями лечения акромегалии являются [1–3]:
- достижение целевых значений ГР и ИФР-1, то есть таких уровней ГР и/или ИФР-1, при которых отмечается регресс клинических симптомов (биохимический контроль);
- полное или частичное уменьшение объема соматотропиномы или стабилизация объема опухоли гипофиза для
- устранения риска развития симптомов, связанных со сдавлением окружающих структур (головные боли, гипопитуитаризм, сдавление хиазмы и др.).
Критериями достижения биохимического контроля акромегалии признаны [1–4]:
- уровень ГР ≤ 2,5 нг/мл;
- подавление секреции ГР < 1,0 нг/мл в ходе теста с нагрузкой глюкозой;
- уровень ИФР-1, соответствующий полу и возрасту пациента.
Биохимические критерии эффективности лечения
В зависимости от применяемых методов лечения используются один или несколько биохимических критериев контроля акромегалии (таблица).

После нейрохирургического удаления соматотропиномы главным показателем активности акромегалии будет концентрация ГР при случайном определении и после нагрузки глюкозой, которая оценивается в первые недели после проведенного вмешательства [1, 2, 5, 6]. Как уже говорилось выше, целями лечения акромегалии являются достижение уровня ГР ≤ 2,5 нг/мл и нормализация ИФР-1, а не снижение показателей по сравнению с исходными. С современных позиций критерием успешного радикального нейрохирургического вмешательства служит не только отсутствие видимых участков опухолевой ткани на контрольных снимках магнитно-резонансной томографии, но и достижение целевых гормональных показателей. Оптимальным периодом для оценки радикальности выполненной операции, исследования уровней ГР и ИФР-1, проведения магнитно-резонансного контроля опухоли гипофиза считается 12–24 недели (три – шесть месяцев) после нейрохирургического вмешательства [1–3]. При обследовании также можно уточнить состояние других гипофизарных функций, чтобы исключить наличие послеоперационного гипопитуитаризма.
Если целевые значения ГР и ИФР-1 достигнуты, далее проводится мониторинг только уровня ИФР-1, причем ежегодно.
В противном случае назначается медикаментозная терапия.
На фоне медикаментозного лечения аналогами соматостатина длительного действия реакция ГР на нагрузку глюкозой может оставаться патологической, поэтому пробу обычно не проводят у пациентов, получающих данные препараты. В такой ситуации для оценки биохимического ответа принципиальное значение имеют показатели ИФР-1 и ГР при случайном определении, которые обычно исследуются каждые три месяца [1–3]. Если аналоги соматостатина назначались в качестве первой линии лечения, дополнительным критерием эффективности является уменьшение объема опухоли на 20% и более от исходного через 12 месяцев [7].
На фоне медикаментозного лечения антагонистом гормона роста пэгвисомантом уровень гормона роста не определяется в принципе, так как таковое не влияет на его концентрацию. В этом случае главным биохимическим показателем будет концентрация ИФР-1 [2–4]. Пэгвисомант не влияет на объем опухоли гипофиза, поэтому уменьшения объема соматотропиномы на фоне терапии не ожидается. Магнитно-резонансный контроль опухолевой ткани проводится для исключения ее роста.
После проведения радиохирургии до наступления эффекта пациенту обычно назначают медикаментозное лечение. Соответственно биохимические критерии будут применяться в зависимости от вида медикаментозной терапии.
Место медикаментозной терапии
Показаниями для назначения медикаментозной терапии являются [1–4]:
- недостижение целевых уровней ГР и ИФР-1 после проведения нейрохирургического вмешательства;
- период после проведения облучения опухоли, до наступления эффекта от лучевого лечения и достижения целевых показателей гормонов;
- маловероятность радикального удаления опухоли, крайне высокий анестезиологический риск или отказ пациента от операции;
- улучшение соматического состояния перед проведением нейрохирургического лечения.
Основной группой препаратов, использующихся в лечении акромегалии, считаются аналоги соматостатина.
Соматостатин, природный гипоталамический гормон, тормозит продукцию ГР гипофизом и пролиферацию соматотрофов. В клинической практике использовать соматостатин невозможно из-за быстрого ферментативного расщепления (период полужизни – две-три минуты), необходимости внутривенного инфузионного введения и феномена рикошета, когда уровень ГР после процедуры значительно повышается относительно исходного значения. Именно поэтому были разработаны аналоги соматостатина длительного действия, которые можно вводить пациентам не чаще одного раза в 28 дней [8, 9].
Длительный опыт использования депонированных форм аналогов соматостатина показал, что такое лечение улучшает качество и продолжительность жизни пациентов с акромегалией независимо от степени тяжести заболевания [8–15]. На фоне лечения октреотидом пролонгированного высвобождения уровня ГР ≤ 2,5 нг/мл и нормализации ИФР-1 достигали 60 и 59% пациентов, ланреотидом аутожелем – 62 и 49% соответственно [16]. При использовании одновременно двух целевых критериев частота биохимического ответа оказалась несколько ниже и в среднем составила около 50%, так как у части больных наблюдалось достижение только одного критерия.
Аналоги соматостатина длительного действия одинаково эффективны как во второй (после нерадикальной аденомэктомии), так и в первой линии лечения [1–4, 9–16]. Не случайно многие международные эксперты предлагают назначать первичную медикаментозную терапию при макроаденомах гипофиза с распространением за пределы турецкого седла (особенно с латероселлярным распространением), но без хиазмального синдрома и/или ликвореи, то есть в тех случаях, когда не требуется срочного оперативного вмешательства и вероятность радикального удаления низка [17]. Это позволяет избежать нейрохирургических осложнений и улучшить состояние пациентов при невозможности выполнения оперативного вмешательства.
Рекомендации об использовании аналогов соматостатина для предоперационной подготовки противоречивы. В настоящее время нет доказательной базы в отношении увеличения частоты радикального удаления опухоли гипофиза после предварительного лечения аналогами соматостатина [18–20]. При невозможности быстрого выполнения нейрохирургического вмешательства в экспертном центре, а также при длительном ожидании такового целесообразно назначать аналоги соматостатина для улучшения самочувствия больных [21].
Побочные неблагоприятные явления аналогов соматостатина представлены местными реакциями (припухлость и высыпания в месте инъекции), уменьшением частоты сердечных сокращений, преходящими болями в животе, тошнотой, метеоризмом, стеатореей [9]. Они наиболее выражены после первого введения препарата и регрессируют при продолжении лечения. У 62% пациентов длительное использование аналогов соматостатина может приводить к холестазу, расширению желчного протока и образованию желчных камней, что требует контрольных ультразвуковых обследований, раннего назначения дезоксиурсохолиевой кислоты и при наличии показаний хирургического лечения желчекаменной болезни [22].
Для лечения акромегалии также применяются агонисты дофаминовых рецепторов, препаратом выбора среди которых является каберголин [1–4, 23, 24]. Каберголин зарегистрирован для лечения гиперпролактинемии, назначение при акромегалии является off-label.
Агонистам дофаминовых рецепторов отводится вспомогательная роль в связи с более низкой эффективностью по сравнению с аналогами соматостатина. Так, применение каберголина в качестве монотерапии способствовало нормализации уровня гормонов не более чем у 10% пациентов, и то при условии умеренного увеличения ИФР-1 (в пределах двукратного превышения верхней границы референсных значений) [23, 24]. На сегодняшний день это единственный вид пероральной терапии акромегалии. Он актуален для больных пожилого возраста, с умеренным повышением ГР и ИФР-1, отказывающихся от инъекций [1, 2, 23, 24].
Эффективность аналогов соматостатина и каберголина ограничена наличием соматостатиновых рецепторов подтипов 2 и 5, дофаминовых рецепторов подтипа 2 в ткани опухоли и некоторыми другими молекулярно-генетическими особенностями соматотропиномы [25].
В 2018 г. в России для лечения акромегалии зарегистрирован антагонист гормона роста пэгвисомант, который блокирует действие избыточных концентраций ГР в периферических тканях [26].
Пэгвисомант представляет собой видоизмененный гормон роста, который более продолжительно связывается с рецептором к гормону роста без активации передачи биологического сигнала.
Эффекты пэгвисоманта не зависят от особенностей опухолевой ткани. Препарат может быть назначен пациентам, не ответившим на лечение аналогами соматостатина и/или каберголином [1–4, 27–29].
Пэгвисомант способствовал нормализации уровня ИФР-1 у 75–90% пациентов с акромегалией [27–29].
Среди нежелательных эффектов пэгвисоманта отмечено повышение концентрации печеночных ферментов. Именно поэтому у пациентов, получающих пегвисомант, требуется мониторирование уровня ферментов печени каждый месяц в течение полугода после старта терапии, затем каждые шесть месяцев при продолжении лечения. В случае повышения уровня ферментов печени в три раза и более пэгвисомант отменяют.
Тактика оптимизации
После старта терапии аналогами соматостатина, с учетом времени достижения равновесной терапевтической концентрации вещества в крови, уровни ГР и ИФР-1 следует определять каждые три месяца в течение первого года. В первые три месяца лечения отмечается максимально возможное снижение уровней ГР и ИФР-1. Это можно считать предиктором эффективности дальнейшего лечения аналогами соматостатина первого поколения [29, 30]. Тем не менее международные эксперты рекомендуют оценивать ответ на лечение через 12 месяцев от его начала [16].
По типу ответа на лечение аналогами соматостатина первого поколения пациентов с акромегалией условно подразделяют:
- на чувствительных – достигших целевых показателей ГР и ИФР-1 и демонстрирующих значимое уменьшение объема соматотропиномы;
- частично резистентных – не достигших целевых показателей, но продемонстрировавших снижение уровней ГР и ИФР-1 на 50% и более от исходных;
- полностью резистентных – тех, у кого не отмечается значимого снижения уровней ГР и ИФР-1.
У чувствительных пациентов (достижение целевых уровней ГР и/или ИФР-1) лечение продолжается тем же препаратом в той же дозе.
У резистентных больных (уровни ГР и/или ИФР-1 не снизились на 50% и более от исходного в течение первых 3–12 месяцев лечения аналогами соматостатина первого поколения в максимальных дозах) продолжать терапию нерационально. В этой ситуации возможными опциями для оптимизации терапии в условиях российской клинической практики будут:
- переключение на пэгвисомант, особенно у пациентов с нарушениями углеводного обмена;
- нейрохирургическое вмешательство, если медикаментозная терапия была терапией первой линии;
радиохирургическое лечение.
Международные эксперты также рекомендуют рассмотреть возможность переключения на пасиреотид длительного действия [31], однако этот препарат не зарегистрирован в России для лечения акромегалии. Нейрохирургическое и/или радиохирургическое вмешательство показано пациентам, у которых требуется контроль массы опухолевой ткани. Если радикальное удаление соматотропиномы невозможно даже в условиях специализированного центра, оправданно комбинированное лечение – удаление максимально возможного объема опухолевой массы, радиохирургическое воздействие на остаточную ткань и назначение пэгвисоманта после оперативного вмешательства.
Пэгвисомант вводят подкожно, ежедневно. На старте терапии одновременная нагрузочная доза составляет 80 мг, что позволяет быстрее достичь терапевтической концентрации препарата в крови. Обычная доза для начала лечения – 10 мг/сут. Дозу титруют каждые четыре – шесть недель, исходя из уровня ИФР-1. Если его содержание не снизилось до референсных значений, дозу увеличивают на 5 мг/сут. Максимальная разрешенная доза пэгвисоманта – 30 мг/сут.
Если целевые уровни ГР и/или ИФР-1 не достигнуты, но их значения снизились на 50% и более, имеет смысл продолжать лечение аналогами соматостатина в максимальных дозах.
Дополнительными опциями оптимизации терапии у частично резистентных пациентов могут быть:
- повышение дозы аналогов соматостатина первого поколения;
- комбинированная терапия аналогами соматостатина и каберголином;
- комбинированная терапия аналогами соматостатина и пэгвисомантом.
Повышение дозы октреотида длительного действия до 40–60 мг в 28 дней приводило к достижению целевых уровней ГР и ИФР-1 еще у 25–30% больных, частично ответивших на лечение октреотидом в дозе 20 мг [32, 33]. При этом высокодозная терапия аналогами соматостатина первого поколения характеризовалась хорошей переносимостью без изменения профиля безопасности.
Назначение агонистов рецепторов дофамина вне зависимости от уровня пролактина может усиливать эффекты аналогов соматостатина. Комбинированная терапия аналогами соматостатина в максимальных дозах (Октреотид-Депо длительного действия 40 мг внутримышечно или ланреотид аутожель 120 мг подкожно один раз в четыре недели) и агонистами дофаминовых рецепторов (каберголин в дозе 3,5–7,0 мг/нед) позволила достичь целевых значений ГР и ИФР-1 у 40–50% больных, частично ответивших на лечение аналогами соматостатина [33–35].
Дополнительное назначение пэгвисоманта к аналогам соматостатина первого поколения также является возможной тактикой оптимизации медикаментозного лечения [33, 35, 36]. К преимуществам такой комбинации следует отнести контроль над массой опухоли, который возможен у большинства пациентов благодаря применению аналогов соматостатина первого поколения, и нормализацию уровня ИФР-1, которая достигается благодаря применению пэгвисоманта [33, 35, 36].
В настоящее время предлагаются схемы с низкими дозами аналогов соматостатина и еженедельным введением пэгвисоманта, что снижает стоимость лечения, а также количество инъекций [37].
Хотелось бы еще раз подчеркнуть, что комбинированное лечение оправданно в тех случаях, когда есть хотя бы частичный ответ на монотерапию аналогами соматостатина первого поколения.
Заключение
Какой бы метод лечения акромегалии ни был выбран в качестве первой линии, важно добиться стабилизации или уменьшения размеров соматотропиномы и целевых концентраций ИФР-1 и, если применимо, ГР.
Для достижения контроля над заболеванием необходимы тщательный мониторинг состояния и последовательные меры по оптимизации медикаментозной терапии.
Управление патологией приведет к улучшению качества жизни пациентов.

 Исторические этапы лечения акромегалии
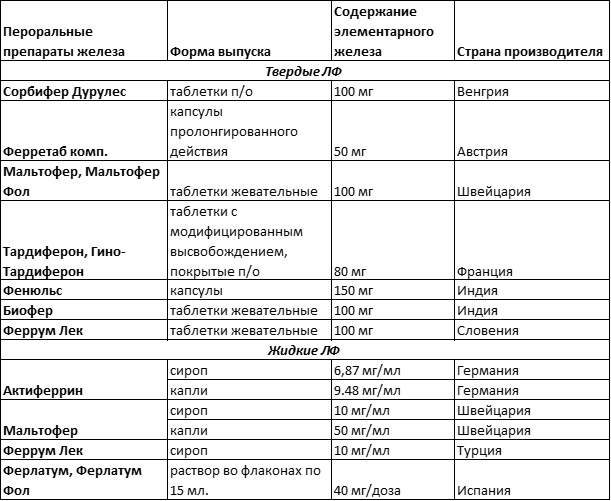
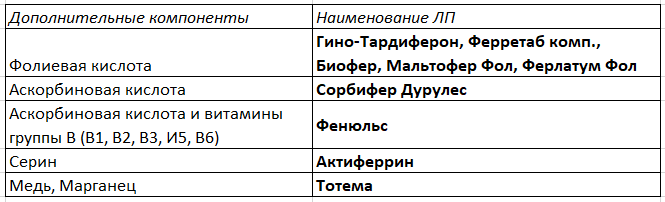
Исторические этапы лечения акромегалии Пероральное железо “без воды”: особенности препаратов, которые важно помнить врачам. + 3 наглядных таблицы
Пероральное железо “без воды”: особенности препаратов, которые важно помнить врачам. + 3 наглядных таблицы

 В последнее время на отраслевых мероприятиях я всё чаще слышу слово «пациентоориентированность». Оно звучит от руководителей фармкомпаний, общественных деятелей, чиновников, политиков и т. д. Причины популярности этого термина у столь разных людей мне понятны: стоящая за ним идея кажется здравой и современной, и под прикрытием «пациентоориентированности» общество готово принять любую инициативу.
В последнее время на отраслевых мероприятиях я всё чаще слышу слово «пациентоориентированность». Оно звучит от руководителей фармкомпаний, общественных деятелей, чиновников, политиков и т. д. Причины популярности этого термина у столь разных людей мне понятны: стоящая за ним идея кажется здравой и современной, и под прикрытием «пациентоориентированности» общество готово принять любую инициативу.







 Учитывая, что у обоих родителей рост выше 182см, мы ожидали высокого ребенка. В возрасте 4 лет рост Клэр не вызывал вопросов. К семи годам, рост Клэр составил 160см, и она была на голову выше своих ровесников.
Учитывая, что у обоих родителей рост выше 182см, мы ожидали высокого ребенка. В возрасте 4 лет рост Клэр не вызывал вопросов. К семи годам, рост Клэр составил 160см, и она была на голову выше своих ровесников.