Е.Ю. Надеждина1*, О.Ю. Реброва1, 2, 3, А.Ю. Григорьев1
1 Национальный медицинский исследовательский
центр эндокринологии
2 Российский национальный исследовательский
медицинский университет им. Н.И. Пирогова
3 Национальный исследовательский университет
«Высшая школа экономики»
Обоснование
Золотым стандартом лечения болезни Иценко−Кушинга является эндоскопическая трансназальная транссфеноидальная аденомэктомия. Ремиссия после этой операции может достигать 90%, при этом вероятность развития рецидивов остается высокой и колеблется от 10 до 47% [1−3].
Ранее нами при одномерном анализе [4], а также другими исследователями [5−10] были выявлены предикторы рецидива после успешной нейрохирургической операции, которыми оказались послеоперационные утренние концентрации адренокортикотропного гормона гипофиза и кортизола.
По данным исследователей, ремиссию у пациентов с болезнью Иценко−Кушинга также можно спрогнозировать по концентрации гормонов в утренней сыворотке крови: для кортизола — <50 [10], <100 [5], <138 [8], <157 [7], <189 [9] нмоль/л, для адренокортикотропного гормона гипофиза в плазме крови — <5 [6] и <10 [5] пг/мл. B. Biller с соавт. [10] указывают значение утреннего кортизола сыворотки крови после операции ≤50 нмоль/л (1,8 мкг/дл), что связано с ремиссией и низкой частотой рецидивов, составляющей приблизительно 10% в течение 10 лет. По результатам исследования Е.И. Маровой и соавт. [5], концентрации кортизола <100,0 нмоль/л и адренокортикотропного гормона гипофиза <10,0 пг/мл в раннем послеоперационном периоде (до 13 сут) после аденомэктомии являются основными факторами, определяющими длительную ремиссию заболевания (чувствительность 93,4% и специфичность 97,3%). В работе доктора F. Esposito и соавт. [8] утренняя концентрация кортизола ≤138 нмоль/л (5 мкг/дл) в послеоперационном периоде ассоциируется с высокой частотой возникновения ремиссии заболевания (до 97%) и является предиктором ремиссии в течение 2−2,7 лет.
В проспективном исследовании R. Starke и соавт. [7] с периодом наблюдения от 1 года до 6 лет концентрация кортизола в сыворотке крови <157 нмоль/л (5,7 мкг/дл) является предиктором ремиссии болезни Иценко−Кушинга.
По результатам исследования F. Costenaro и соавт. [9], концентрация кортизола <189 нмоль/л в послеоперационном периоде (10−12-е сутки после удаления опухоли) является предиктором длительной ремиссии. В исследовании P. Johnston и соавт. [6] именно послеоперационный утренний адренокортикотропный гормон гипофиза ≤5 пг/мл был достоверно связан с длительной ремиссией у пациентов с болезнью Иценко−Кушинга за 10-летний период наблюдения (р=0,001).
Нами, так же как и другими авторами [5, 7, 11], не выявлено влияния на вероятность рецидива таких факторов, как пол, возраст, длительность заболевания, размер аденомы по данным магнитно-резонансной томографии головного мозга. Для этих гормонов, определенных электрохемилюминесцентным методом, по результатам ROC-анализа оптимальными отрезными точками, дифференцирующими состояния ремиссии и рецидива в первые 3 года после операции, оказались 123 нмоль/л и 7 пг/мл соответственно. Вероятность рецидива в 3,4 раза выше при концентрации кортизола ≥123 нмоль/л и в 4,5 раза выше при значениях адренокортикотропного гормона гипофиза ≥7 пг/мл [4]. Однако показатели гормонов в 58% случаев оказались диссоциированными, т.е. противоречивыми в отношении прогноза [4], что не позволяет использовать отдельно каждый из них для прогнозирования рецидива и ремиссии.
При этом анализ прогностической ценности сочетаний концентраций этих двух гормонов ранее не проводился.
Цель
Разработать правила прогнозирования рецидива и ремиссии в первые 3 года после успешного нейрохирургического лечения болезни Иценко−Кушинга.
Методы
Дизайн исследования
Проведено ретроспективное сравнительное (случайконтроль) одноцентровое исследование.
Критерии соответствия
В исследование включены пациенты с болезнью Иценко−Кушинга, которые после трансназальной аденомэктомии, выполненной в 2007−2014 гг. в ФГБУ «Эндокринологический научный центр» Минздрава России, имели послеоперационную ремиссию заболевания.
Критерии включения: пациенты в возрасте 15 лет и старше с установленным диагнозом болезни Иценко−Кушинга после эндоскопической трансназальной аденомэктомии и лабораторно подтвержденной послеоперационной (до 10 сут) ремиссией заболевания (развитие лабораторно подтвержденной уровнями адренокортикотропного гормона гипофиза в плазме и кортизола в сыворотке крови надпочечниковой недостаточности (референсные значения 7−66 пг/мл и 123−626 нмоль/л соответственно)). При нормальных концентрациях гормонов дополнительно контролировались величины свободного кортизола в суточной моче и/или свободного кортизола в вечерней слюне, референсные интервалы которых должны были находиться в пределах 60−413 нмоль/сут и 0,5−9,4 нмоль/л соответственно.
Критерии исключения: наличие в анамнезе у пациентов лучевого или нейрохирургического лечения по поводу болезни Иценко−Кушинга.
Для формирования выборки был использован сплошной метод.
Продолжительность исследования
Исследование проведено в период 2014−2018 гг. Основной исход исследования Основной оцененной в исследовании конечной точкой был срок возникновения рецидива.
Методы регистрации исходов
Рецидив заболевания определяли по критериям, описанным в клинических рекомендациях [10].
Концентрации адренокортикотропного гормона гипофиза и кортизола определяли электрохемилюминесцентным методом с использованием анализатора Сobas 600 (Roche, Франция).
Этическая экспертиза
Исследование одобрено Локальным этическим комитетом (Протокол № 19 от 26 декабря 2012).
Статистический анализ
Распределения количественных признаков описаны медианами (Me) и интерквартильными интервалами [Q1; Q3], для сравнения групп использовался тест Манна−Уитни. Анализ времени до события осуществлялся методом Каплана−Мейера. Сопряженность бинарных признаков оценивалась с помощью двустороннего точного критерия Фишера (ТКФ). Для правил прогнозирования
рассчитывали чувствительность, специфичность, прогностические ценности положительного и отрицательного результатов и их 95% доверительные интервалы (ДИ) по методу Клоппера−Пирсона. Данные анализировались с использованием пакета прикладных программ Statistica v. 13 (TIBCO, США).
Результаты
Объекты (участники) исследования
В исследование включены 349 пациентов, в том числе 52 мужчины и 297 женщин. Возраст пациентов на момент операции составил от 15 до 66 лет, медиана и квартили 38 [29; 48] лет, длительность заболевания — от 4 мес до 22 лет.
Основные результаты исследования
У 58 из 349 пациентов, включенных в исследование, развился рецидив в сроки от 4,4 мес до 9 лет (26 [17; 35] мес); рис. 1.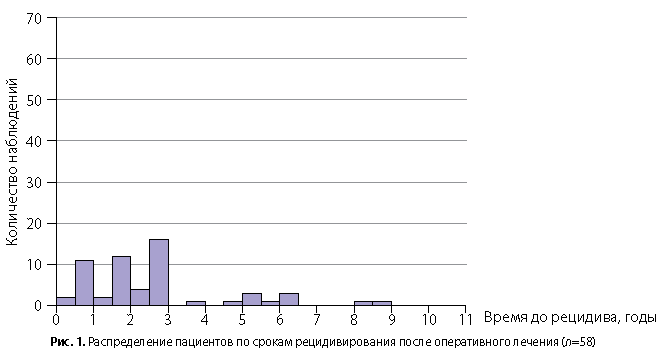
У 291 пациента сохранялась ремиссия в сроки наблюдения от 5 дней до 11 лет (40 [8; 62] мес); рис. 2.
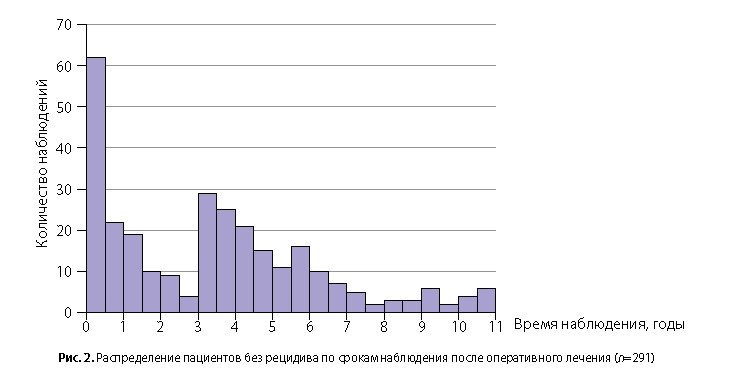
Различия сроков наблюдения статистически незначимы (p=0,149, тест Манна−Уитни).
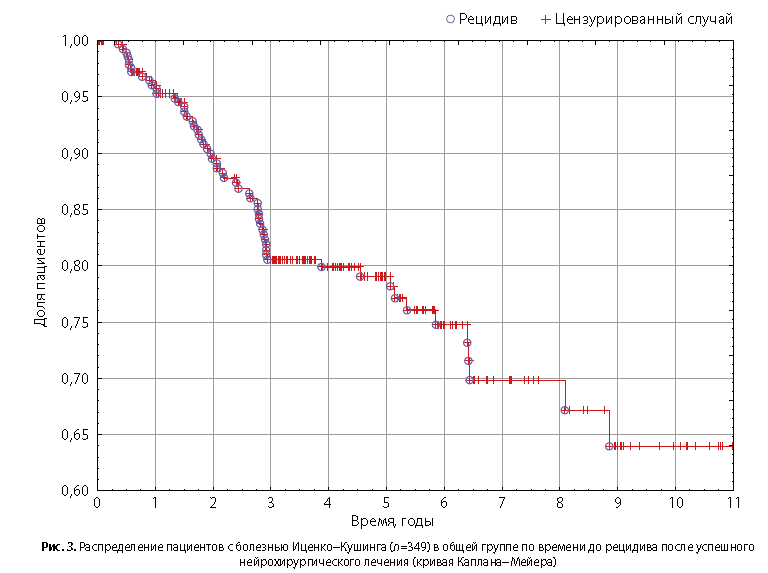
Исходя из результатов анализа времени до события методом Каплана−Мейера (рис. 3), частота наступления рецидива в срок до 1 года составила 4,7% (95% ДИ 2,2–7,2%), до 2 лет — 10,5% (95% ДИ 6,7–14,2%), до 3 лет — 19,5% (95% ДИ 14,4–24,5%), до 4 лет — 20,1% (95% ДИ 15,0–25,3%), до 5 лет — 20,9% (95% ДИ 15,6–26,3%).
С целью поиска правил прогнозирования рецидива и ремиссии в разные сроки нами проанализированы послеоперационные утренние показатели адренокортикотропного гормона гипофиза и кортизола (табл. 1), которые оказались противоречивыми в 41% ((133+11)/349) случаев, что подтвердило невозможность использования каждого из них отдельно для прогнозирования рецидива/ремиссии.

Далее была оценена частота сочетаний уровней двух этих гормонов для пациентов с ремиссией не менее 1 года либо рецидивом в течение первого года после операции (n=262; табл. 2) и пациентов с ремиссией не менее трех лет либо рецидивом в течение первых трех лет после операции (n=223; табл. 3).


Из табл. 2 видно, что 10 из 13 (77%) рецидивов возникли у пациентов с нормальным содержанием обоих гормонов, и в то же время только 17% (43 из 249) пациентов с ремиссией имели такие сочетания уровней гормонов, поэтому мы объединили все остальные сочетания в одну категорию с целью построения правила прогноза (табл. 4).

Аналогично было сделано для прогнозирования рецидива к трем годам (табл. 5). В обеих таблицах частот имеется сопряженность бинарных показателей (p<0,001, ТКФ).

На основании частоты сочетания уровней послеоперационного содержания гормонов в утренних анализах крови, представленных в табл. 4, можно предложить способ прогнозирования рецидива в срок 1 год по сочетаниям уровней адренокортикотропного гормона гипофиза и кортизола. Этот способ прогнозирования имеет следующие операционные характеристики: чувствительность 77% (95% ДИ 46–95%), специфичность 83% (95% ДИ 78−88%), прогностическая ценность положительного результата 19% (95% ДИ 9−32%), прогностическая ценность отрицательного результата 99% (95% ДИ 97−100%), общая точность 82% (95% ДИ 77−87%). Прогностическая ценность отрицательного результата достаточно велика, поэтому можно сформулировать следующее правило для персонализированного ведения пациента: если хотя бы один из двух гормонов (утренний адренокортикотропный гормон гипофиза или утренний кортизол) после операции имеет значение ниже отрезной точки (7 пг/мл и 123 нмоль/л соответственно), пациент с вероятностью 99% (95% ДИ 97–100%) будет иметь ремиссию в течение 1 года. Поскольку доля пациентов с отрицательным прогнозом достаточно велика (209/262; 80%), такое правило потенциально может позволить организовать более клинико-экономически эффективное послеоперационное ведение пациентов.
Из частоты сочетания уровней послеоперационного утреннего содержания гормонов, представленных в табл. 5, следует, что чувствительность способа прогнозирования рецидива в срок до 3 лет по уровням двух гормонов составляет 49% (95% ДИ 36–61%), специфичность 86% (95% ДИ 82–89%), прогностическая ценность положительного результата 48% (95% ДИ 36–60%), прогностическая ценность отрицательного результата 86% (95% ДИ 80–91%), общая точность 78% (95% ДИ 72–83%).
Максимальным прогностическим значением также обладает отрицательный результат, поэтому правило прогнозирования может быть следующим: если хотя бы один из двух гормонов (утренний адренокортикотропный гормон гипофиза или утренний кортизол) после операции имеет значение ниже отрезной точки (7 пг/мл и 123 нмоль/л соответственно), пациент с вероятностью 86% (95% ДИ 80–91%) будет иметь ремиссию в течение 3 лет.
Однако все же для практического применения это правило представляется недостаточно точным.
Нежелательные явления не оценивались.
Обсуждение
Согласно многочисленным исследованиям прогностических параметров рецидива и ремиссии болезни Иценко−Кушинга, предикторами могут выступать уровни утреннего послеоперационного содержания в крови адренокортикотропного гормона гипофиза и кортизола [5−11], однако никем из исследователей не был предложен какой-либо способ интерпретации их концентраций, которые, по нашим данным, оказались противоречивыми в 41% случаев (см. табл. 1). Таким образом, нами впервые предложен способ прогнозирования рецидива и ремиссии болезни Иценко−Кушинга по сочетаниям уровней этих двух гормонов. Построенные правила прогнозирования не вполне совершенны по своим характеристикам, что связано с малым количеством случаев рецидива. В случае продолжения сбора данных с большой вероятностью удастся построить более надежное правило. Тем не менее на основе способа прогнозирования ремиссии на 1 год, обладающего высокой вероятностью правильного ответа, мы сочли возможным предложить алгоритм ведения пациентов в первый год после успешной нейрохирургической операции.
На основании разработанного правила прогнозирования на срок 1 год, выявленных сроков рецидивирования в течение первого года, а также с учетом наличия у пациентов множественных осложнений гиперкортицизма можно предложить следующий алгоритм персонализированного ведения пациента после операции (рис. 4).
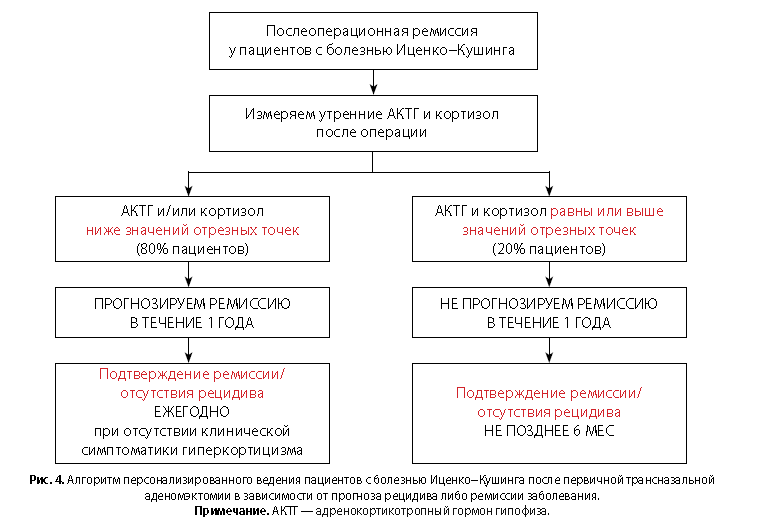
- У пациента измеряются послеоперационные уровни адренокортикотропного гормона гипофиза и кортизола.
- Если уровень хотя бы одного из этих гормонов (адренокортикотропного гормона гипофиза или кортизола) ниже нижней границы референсного диапазона (7 пг/мл для адренокортикотропного гормона гипофиза или 123 нмоль/л для кортизола), то у данного пациента прогнозируется ремиссия в течение 1 года с вероятностью 99% (95% ДИ 97–100%), и пациента рекомендуется приглашать на контроль для оценки ремиссии через 1 год.
- Если оба гормона (послеоперационные утренние адренокортикотропный гормон гипофиза и кортизол) имеют значения большие или равные 7 пг/мл и 123 нмоль/л соответственно, пациенту рекомендован контроль не позднее 6 мес после операции с последующим обследованием в стационаре через 1 год.
- При возобновлении у пациента клинической картины (симптоматики) гиперкортицизма необходимо обращение в специализированный стационар.
Ограничения исследования
В силу ретроспективного дизайна исследования возможно историческое смещение в оценке лабораторных показателей. Несмотря на то, что проанализированы данные за 8 лет, выборка все же недостаточно велика (особенно в части случаев рецидива), т.к. низкая скорость возникновения изучаемых событий определяет необходимость весьма длительного сбора данных.
Заключение
Разработаны правила прогнозирования ремиссии в течение 1 года и 3 лет после операции для пациентов, подвергшихся нейрохирургическому лечению по поводу болезни Иценко−Кушинга, основанные на сочетаниях послеоперационных утренних значений адренокортикотропного гормона гипофиза и кортизола. На основе одного из правил предложен алгоритм ведения пациентов, эффективность и безопасность которого в дальнейшем должны быть оценены в проспективном контролируемом исследовании.
Представляется целесообразным дальнейший сбор данных о пациентах, прооперированных после 2014 г., с целью увеличения объема выборки катамнестического наблюдения, что позволит в дальнейшем построить более эффективные прогностические правила для реализации персонализированного ведения пациентов.
Источник: Журнал «Проблемы эндокринологии» №1, 2020
Ссылка на оригинал: https://www.probl-endojournals.ru/jour/article/view/10149/9645
