Мельниченко Г.А., Станоевич И.В., Селиванова Л.С., Воротникова С.Ю., Ткачук А.В., Луценко А.С.
Национальный медицинский исследовательский центр эндокринологии Минздрава России
Акромегалия – редкое (60–85 случаев на 1 млн населения) медленно прогрессирующее нейроэндокринное заболевание, обусловленное избыточной секрецией соматотропного гормона (СТГ) аденомой гипофиза, что приводит к повышению продукции инсулиноподобного фактора роста 1-го типа (ИФР-1) печенью [1]. Основной акушерско-гинекологической проблемой у пациенток репродуктивного возраста, которые составляют не менее трети общего количества женщин, страдающих акромегалией, является эндокринное бесплодие и гипоменструальный синдром вследствие хронической ановуляции. В связи с этим особую актуальность приобретает возможность реализации генеративной функции у больных с сохранным двухфазным менструальным ритмом до проведения нейрохирургического лечения, которое может повлечь развитие гипопитуитаризма: гипогонадотропного гипогонадизма, вторичного гипотиреоза и надпочечниковой недостаточности в различных
сочетаниях (до 5% наблюдений) [2–4].
«Мягкое» клиниколабораторное течение активной стадии акромегалии, неполная ремиссия после повторного нейрохирургического вмешательства или длительная стабильная компенсация на фоне терапии аналогами соматостатина позволяет ряду зарубежных школ нейроэндокринологов допускать подобных пациенток к деторождению [5–11]. Однако, по данным отечественных авторов, беременность у больных, страдающих акромегалией, нередко заканчивается самопроизвольным абортом, причем на сроке более 10 нед – в 50% наблюдений, что указывает на особенности эмбрионально-эндометриального взаимодействия и плацентации в условия повышенной продукции ИФР-1 печенью матери под действием СТГ и неуточненные возможности профилактики невынашивания беременности при данной нейроэндокринной патологии [2].
Локальная продукция в эндометрии ИФР-1 рассматривается большинством авторов как важнейший фактор гестационного ремоделирования эндометрия и развития ворсин хориона [3, 12–14]. Низкое содержание ИФР-1 в сыворотке крови и плаценте ассоциировано с синдромом внутриутробной задержки роста плода и преэклампсией [15]. Указанные факты позволяют рассматривать пациенток репродуктивного возраста с сохранным двухфазным менструальным ритмом, страдающих активной стадией акромегалии, в качестве уникальной модели для изучения in vivo рецептивности эндометрия в условиях длительного системного повышения ИФР-1 [16].
Цель – определение рецептивности эндометрия у пациенток с активной стадией акромегалии на основании иммуногистохимической оценки экспрессии рецепторов эстрогенов (ER), прогестерона (PR), лейкемия-ингибирующего фактора (LIF) в слизистой оболочке матки средней стадии фазы секреции.
Пациенты и методы
Основная группа (1-я группа) представлена 12 образцами секреторного эндометрия больных репродуктивного возраста с впервые установленным диагнозом акромегалии (до начала лечения), нормальными значениями пролактина сыворотки крови и сохранным двухфазным менструальным ритмом; группа сравнения (2-я группа) А – образцами секреторного эндометрия 16 женщин без доброкачественных заболеваний внутренних гениталий и нейроэндокринной патологии; группа сравнения Б – образцами секреторного эндометрия 14 пациенток без нейроэндокринной патологии, страдающих миомой матки и/или аденомиозом. Средний возраст больных составил 40,1 ± 4,2; 35,8 ± 6,1 и 37,2 ± 3,6 лет соответственно. Материал для проведения морфологического исследования получен путем аспирационной биопсии или раздельного диагностического выскабливания.
Рецептивность эндометрия оценивали путем определения экспрессии PR, ER, LIF в эпителиальных и стромальных клетках слизистой оболочки матки иммуногистохимическим методом [17, 18].
Материал, полученный от пациентов, фиксировали в 10%-м забуференном формалине, обрабатывали в аппарате гистологической проводки фирмы «Leica» и заливали в парафин.
Суммарное время фиксации, проводки и заливки материала не превышало 48 ч. Затем готовили серийные срезы (не менее 10) толщиной 3–4 мкм, которые помещали на полилизиновые стекла (Leica, Германия) и инкубировали в термостате при температуре 37°C в течении 12 ч. Далее срезы последовательно депарафинировали в ряде растворов, состоящем из 3 ксилолов, 2 абсолютных спиртов, 80–70%-го спирта и дистиллированной воды. Затем препараты окрашивали гематоксилином и эозином по стандартной методике. Отсутствие морфологических признаков секреторных изменений эндометрия являлось критерием исключения клинического наблюдения из группы.
Иммуногистохимическое исследование проведено на срезах толщиной 3 мкм, расположенных на стеклах с полилизиновым слоем (Leica, Германия). Исследование проводили на полностью автоматизированном иммуногистостейнере Leica Bond max (Германия), позволяющем депарафинизировать срезы, проводить инкубацию с антителами при постоянной заданной температуре, проводить энзиматическую демаскировку антигенов, высокотемпературную демаскировку антигенов в буферах pH 6,0 и 8,8, подкрашивать препараты гематоксилином. Исследование проводилось по стандартным протоколам, рекомендованным фирмой-производителем, с антителами к ER (моноклональные мышиные, ready-to-use, Leica); к PR (моноклональные кроличьи, ready-to-use, Leica); к LIF (моноклональные
мышиные, 1:100, Genotex).
Оценка экспрессии ER и PR проведена по системе HISTOScore (HS) в % по формуле: HS = 3а + 2b + 1с, где числа от 1 до 3 отражают интенсивность окрашивания, выраженную в баллах; а, b, с – соответственно доли интенсивно, умеренно и слабо окрашенных клеток, выраженные в процентах. Степень выраженности экспрессии ER и PR оценивали в процентах: 0–10% – отсутствие экспрессии, 11–100% – слабая экспрессия, 101–200% – умеренная экспрессия, 201–300% – выраженная экспрессия [19].
Оценка экспрессии LIF проведена полуколичественным методом по шестибалльной системе: 2 балла – до 20% окрашенных клеток; 4 балла – от 20 до 40% окрашенных клеток; 6 баллов – более 40% окрашенных клеток [19].
Для иммуногистохимических реакций ставили положительные и отрицательные контроли, которые выбирали в соответствии со спецификациями от фирмы производителя.
Все препараты прошли сканирование на сканирующей системе Leica, позволяющей получать высокоточные изображения гистологических препаратов и создавать полноценное изображение, которое возможно подвергать многократному увеличению, что позволяет просматривать отдельные фрагменты микропрепарата в высоком качестве, максимально приближенному к тому, которое традиционно получают с помощью светового микроскопа.
Статистическую обработку данных проводили с помощью пакета прикладных программ STATISTICA (версия 6.0).
Оценку репрезентативности групп/подгрупп определяли по формулам оценки репрезентативности для количественных и качественных признаков при неодинаковом числе наблюдений в группах/подгруппах. Все полученные количественные данные обработаны методом вариационной статистики.
Для каждого количественного параметра определены среднее значение (М), среднеквадратичное отклонение (δ), ошибка среднего (m), 95%-й доверительный интервал. Для выявления различий между группами использовали однофакторный дисперсионный анализ. Достоверность различий определяли для уровня значимости p < 0,05 (95%-й уровень значимости).
Результаты исследования и их обсуждение
Экспрессия ER и PR выявлялась в виде коричневого окрашивания ядер эпителиальных и стромальных клеток эндометрия, LIF – в виде коричневого окрашивания цитоплазматической мембраны.
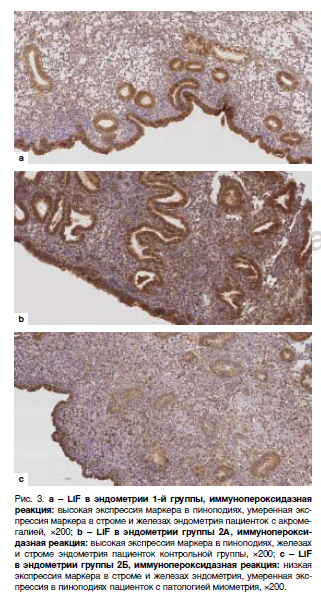
Типичные примеры микроскопической картины экспрессии ER, PR и LIF в секреторном эндометрии женщин – представительниц группы 1, 2A и 2Б отражены на рис. 1 (ER), 2 (PR) и 3 (LIF).
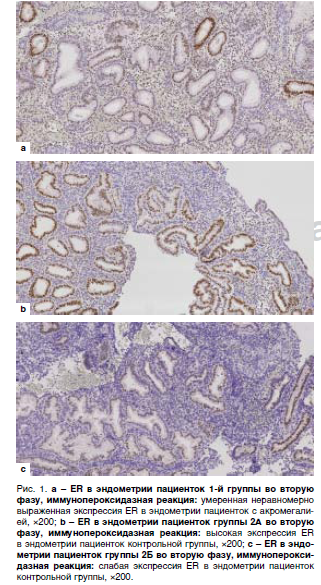
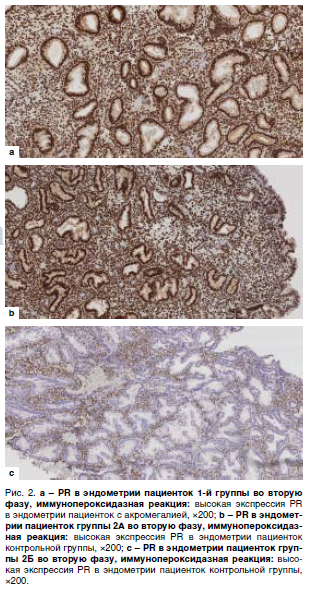
Уровень экспрессии ER и PR в группах 1, 2A и 2Б в эпителии и строме отражен в табл. 1.
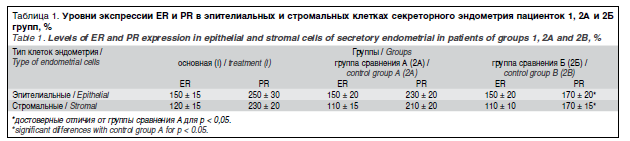
Достоверных отличий экспрессии ER и PR между 1-й группой и группой 2А не выявлено, что указывает на сохраненную чувствительность к эстрогенам и прогестерону эндометрия второй фазы у женщин, страдающих активной стадией акромегалии. Группа 2Б характеризовалась меньшей экспрессией рецепторов половых стероидов: достоверно меньшие значения получены по экспрессии PR как в эпителии, так и строме слизистой оболочки матки пациенток без акромегалии, страдающих миомой матки и/или аденомиозом.
Полученные данные возможно интерпретировать в пользу отсутствия негативного влияния длительного хронического повышения ИФР-1 и СТГ на экспрессию рецепторов эстрогенов и прогестерона в эндометрии пациенток без клинико-морфологических признаков хронической ановуляции, основной причиной которой при акромегалии служит гиперпролактинемия вследствие масс-эффекта опухоли или ее смешанного характера секреции (соматопролактинома) [3, 4].
Образцы секреторного эндометрия больных, страдающих изолированными или сочетанными миомой матки и аденомиозом, продемонстрировали достоверно меньшую чувствительность стромальных клеток к прогестерону, что является одной из молекулярных основ неполноценной децидуализации эндометрия на ранних сроках беременности с повышением риска непосредственно связанных с этим процессом событий: самопроизвольного аборта, недостаточности первой волны инвазии трофобласта и создании предпосылок для патологии второй волны инвазии [2, 15].
Уровень экспрессии LIF в группах 1, 2A и 2Б в эпителии и строме, а также поверхностных эпителиоцитах, содержащих зрелые пиноподии, отражен в табл. 2.
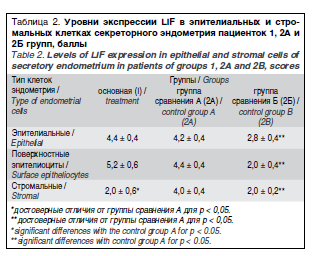
Образцы эндометрия больных, страдающих активной стадией акромегалии, не отличались от группы 2A по экспрессии LIF, как в целом, в эпителиальных клетках, так и в поверхностных эпителиоцитах, содержащих зрелые пиноподии, что может быть интерпретировано в пользу сохранных процессов адгезии и начальных этапов нидации бластоцисты при соматотропиномах в отсутствии ановуляции, учитывая локальную роль данного фактора в развитии беременности [3, 17, 20, 21]. Однако достоверно более низкая экспрессия (в два раза меньшая) LIF в строме эндометрия при достаточной его экспрессии в эпителии на фоне усиленного ИФР-1-сигналинга вследствие акромегалии, по нашему мнению, является одним из ведущих патогенетических факторов повышенной частоты потери беременности после 10–11-й недели беременности, а также высокого риска «больших» акушерских синдромов при СТГ-продуцирующих аденомах гипофиза [2, 21]. По-видимому, уровень стромальной экспрессии LIF, наряду с количественными и качественными характеристиками естественных киллеров в эндометрии, участвует в формировании иммунологической толерантности материнского организма к эмбриону и плоду [12–15, 19, 21].
Согласно данным Youssef et Han, ИФР-1 совместно с ИФР-2 играет важнейшую роль в поддержании плюрипотентности плацентарных мезенхимальных стволовых клеток при условии низкого напряжения кислорода в тканях на мышиных моделях [13]. Достаточная экспрессия LIF поддерживает плюрипотентность и пролиферацию стромальных клеток эндометрия человека [20]. По нашему мнению, в становлении и физиологическом функционировании системы мать–плацента–плод важнейшее значение приобретают структурные и функциональные характеристики децидуальной оболочки, требующие не только пролиферации, но и высокой специализации достигнутого пула стволовых клеток.
Принимая во внимание данные отечественных исследователей по срокам и характеру акушерской патологии при акромегалии, а также собственные полученные данные, свидетельствующие о сниженной экспрессии LIF в строме секреторного эндометрия больных 1-й группы, выявленная особенность может быть важным патогенетическим фактором акушерской патологии второй половины беременности [2, 22].
Секреторный эндометрий пациенток группы 2Б характеризовался достоверно меньшей экспрессией LIF, как в эпителиальных, так и стромальных клетках, что согласуется с данными литературы о нарушении рецептивности слизистой оболочки матки при аденомиозе и лейомиоме [17, 19, 23].
Заключение
Полученные данные свидетельствуют об отсутствии достоверных отличий по чувствительности к эстрогенам и прогестерону при сохранном двухфазном менструальном ритме у пациенток репродуктивного возраста, страдающих активной стадией акромегалии. Однако, несмотря на отсутствие снижения экспрессии LIF в эпителии, в том числе пиноподиях, нами впервые выявлено снижение экспрессии LIF в строме эндометрия, что может отрицательно влиять на формирование иммунологической толерантности к эмбриону и быть одним из патогенетических факторов повышенного риска акушерских осложнений при акромегалии.
Источник: Журнал «Вопросы гинекологии, акушерства и перинатологии». 2018; 17(6): 12–18.
Ссылка на оригинал: http://www.phdynasty.ru/upload/medialibrary/22d/22d8bbad0c87624c58c289e882772035.pdf
