АННОТАЦИЯ
Акромегалия — тяжелое инвалидизирующее нейроэндокринное заболевание, обусловленное длительной избыточной продукцией соматотропного гормона и инсулиноподобного фактора роста-1 у лиц с завершенным физиологическим ростом. Проблема резистентности к медикаментозной терапии у пациентов с акромегалией является достаточно распространенной в клинической практике и требует персонализированного подхода с учетом различных клинико-морфологических, молекулярно-генетических и лабораторных предикторов чувствительности к выбору метода лечения. На сегодняшний день аналоги соматостатина первого поколения в большинстве случаев являются препаратами первой линии в медикаментозном лечении акромегалии, однако до 50% пациентов не достигают биохимической ремиссии заболевания. Прогноз чувствительности к аналогам соматостатина имеет огромное значение, а выделение пациентов, у которых данная терапия будет заведомо неуспешной, позволяет сразу предложить альтернативное лечение. В представленном обзоре обобщены потенциальные предикторы чувствительности и резистентности к существующему медикаментозному лечению акромегалии, обсуждаются возможные пути и способы преодоления возникшей резистентности к терапии, предложены варианты персонализированного подхода при выборе лечебной стратегии в отсутствие контроля заболевания на фоне монотерапии аналогами соматостатина, в том числе комбинации «off-label». Своевременное добавление антагониста рецептора гормона роста — пэгвисоманта — позволяет избежать повторного нейрохирургического вмешательства, лучевой терапии или назначения избыточно высоких доз аналогов соматостатина. Оптимальное использование моно- или комбинированной терапии способствует достижению биохимической ремиссии у большинства резистентных к лечению пациентов.
ПОИСК И КРИТЕРИИ ОТБОРА ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ
При подготовке литературного обзора были использованы базы данных Национальной медицинской библиотеки США (PubMed (MEDLINE)), научной электронной библиотеки eLIBRARY.RU, научной электронной библиотеки КиберЛенинка (cyberleninka.ru). В рассмотрение включались обзорные статьи, метаанализы, рандомизированные и нерандомизированные контролируемые клинические исследования, международные консенсусы. Ключевыми словами на русском языке в поиске являлись: акромегалия; биохимический контроль; медикаментозная терапия; резистентность; предиктивные биомаркеры; аналоги соматостатина; октреотид; ланреотид; пасиреотид; агонисты дофамина; пэгвисомант; комбинированная терапия. Ключевые слова на английском языке: acromegaly; biochemical control; medical therapy; resistance; predictive biomarkers; somatostatin receptor ligands; octreotide; lanreotide; pasireotide; dopamine agonists; pegvisomant; combined therapy. Для повышения специфичности и ограничения чувствительности поиска использовался оператор «AND».
ВВЕДЕНИЕ
Акромегалия — тяжелое нейроэндокринное заболевание, обусловленное длительной избыточной продукцией соматотропного гормона (СТГ) и опосредованной им гиперсекрецией инсулиноподобного фактора роста-1 (ИФР-1) у лиц с завершенным физиологическим ростом [1]. Распространенность акромегалии, по разным данным, составляет 28–137 случаев на 1 млн населения, заболеваемость — 2–11 новых случаев на 1 млн в год [2–4]. В отсутствие своевременного и адекватного лечения акромегалия приводит к развитию многообразных осложнений, прогрессирующей инвалидизации, значительно сокращает продолжительность жизни [2]. Основными причинами ранней смертности становятся осложнения, вызванные длительной гиперпродукцией СТГ: сердечно-сосудистые заболевания, сахарный диабет и его осложнения (микро- и макроангиопатии), заболевания органов дыхания, злокачественные новообразования желудочно-кишечного тракта (ЖКТ) и некоторые другие [5].
Современные подходы к лечению акромегалии направлены на снижение выраженности симптомов, профилактику и коррекцию осложнений заболевания, уменьшение размеров опухоли, секретирующей СТГ, нормализацию биохимических маркеров активности акромегалии. Достижение этих целей позволяет увеличить выживаемость и повысить качество жизни пациентов [6].
СОВРЕМЕННЫЕ МЕТОДЫ ЛЕЧЕНИЯ АКРОМЕГАЛИИ
В настоящее время доступны три метода лечения акромегалии — нейрохирургический (эндоскопическая аденомэктомия трансназальным транссфеноидальным доступом), медикаментозная терапия (аналоги соматостатина, агонисты дофамина и антагонисты рецептора СТГ), фракционная стереотаксическая лучевая терапия или стереотаксическая радиохирургия [1][6][7]. Согласно международным консенсусам и российским клиническим рекомендациям, оперативное вмешательство является приоритетным методом лечения, позволяя добиться быстрой нормализации уровней СТГ и ИФР-1 [6][7]. Основной фактор, во многом определяющий успех оперативного лечения, — квалификация нейрохирурга, тогда как радикальность удаления соматотропином в первую очередь зависит от размеров и степени инвазии опухоли в кавернозный синус [8]. Однако долгосрочный биохимический контроль заболевания после резекции опухоли достигается менее чем в 65% случаев [9][10]. В основном это объясняется преобладанием макроаденом гипофиза, составляющих 82% по данным единого Российского регистра опухолей гипоталамо-гипофизарной области [1], что не позволяет полностью резецировать опухоль и исходно относится к предикторам неблагоприятного послеоперационного прогноза. Аналогичные данные по частоте встречаемости макроаденом среди пациентов с акромегалией представлены в объединенном национальном регистре акромегалии (19 стран) [11].
Лучевая терапия обычно рассматривается в качестве дополнительного метода лечения при неэффективности нейрохирургического лечения и резистентности опухоли гипофиза к консервативной терапии. На сегодняшний день лучевая терапия в нашей стране, как и в ряде других стран, занимает последнее место по значимости в лечении акромегалии [1][11]. Негативными следствиями лучевой терапии являются отсроченный клинический эффект и высокий процент развития гипопитуитаризма (до 50% случаев), а частота достижения ремиссии заболевания после проведенного стереотаксического радиохирургического вмешательства составляет от 25 до 60% в течение последующих 10–15 лет и требует назначения медикаментозного лечения на длительный период [12][13].
За последние десятилетия в клиническую практику вошли новые фармакологические препараты разнонаправленного действия, доказавшие свою эффективность в отношении контроля секреторной и в некоторых случаях пролиферативной опухолевой активности. В связи с совершенствованием и распространением нейрохирургического лечения медикаментозная терапия преимущественно применяется в качестве второй линии, назначаемой в случае неэффективности предшествующей транссфеноидальной аденомэктомии [6].
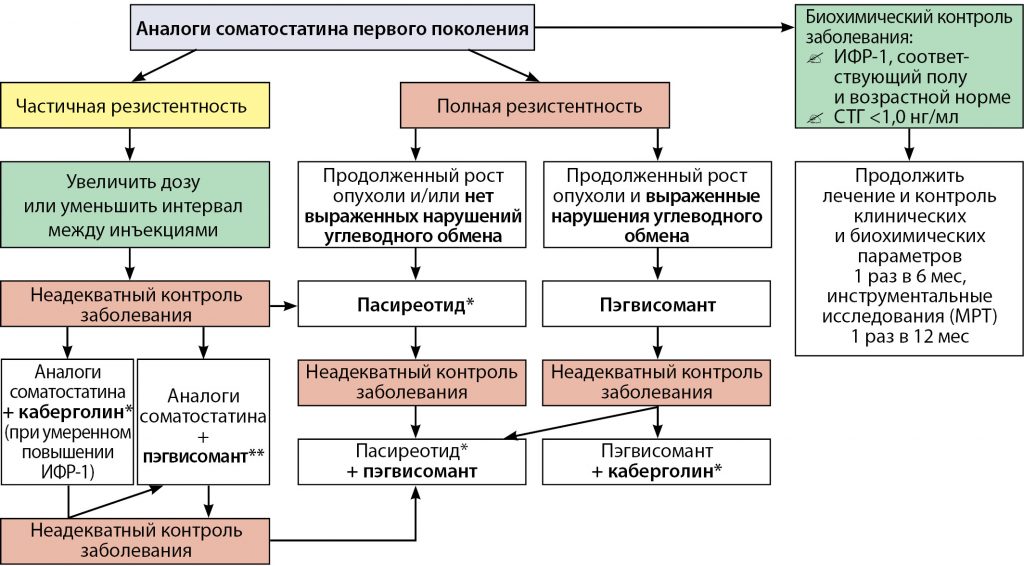
На сегодняшний день аналоги соматостатина первого поколения (октреотид и ланреотид) в большинстве случаев считаются препаратами первой линии в медикаментозном лечении акромегалии, в то время как агонисты дофамина и антагонисты рецептора СТГ принято назначать при неэффективности аналогов соматостатина [7][14]. При недостаточной эффективности монотерапии практикуется комбинированная медикаментозная терапия (рис. 1).
АНАЛОГИ СОМАТОСТАТИНА ПЕРВОГО ПОКОЛЕНИЯ, ИСПОЛЬЗУЕМЫЕ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Октреотид — первый аналог соматостатина, используемый в клинической практике с середины 1980-х гг. Для длительного лечения акромегалии препараты октреотида короткого действия в настоящее время не применяются в связи с необходимостью частых инъекций. Их назначение возможно в качестве дополнения к октреотиду пролонгированного действия при выраженном цефалгическом синдроме [6].
Другим активно используемым синтетическим аналогом соматостатина первого поколения является ланреотид, представляющий собой синтетический пептид, в состав которого включены аминокислоты D-аланин и D-триптофан, способствующие увеличению стабильности молекулы и повышению избирательности связывания с соматостатиновыми рецепторами (ССР) [15].
Показаниями к терапии аналогами соматостатина являются ожидание эффекта лучевой терапии, нерадикальность проведенной транссфеноидальной аденомэктомии, наличие противопоказаний к оперативному лечению в связи с соматическим статусом пациента или особенностями роста опухоли, а также отказом больного от хирургического вмешательства [16]. Имеются сообщения о возможном применении данной группы препаратов с целью купирования цефалгического синдрома в предоперационном периоде [17].
Согласно метаанализу, опубликованному в 2005 г., аналоги соматостатина первого поколения эффективны в отношении нормализации уровней СТГ и ИФР-1 приблизительно у 55% пациентов [18]. В более поздних исследованиях частота достижения безопасного уровня СТГ и нормализации ИФР-1 снизилась до 20–30% на фоне лечения октреотидом и до 30–50% при приеме ланреотида [19–21]. Подобные расхождения в результатах исследований обусловлены предварительным отбором заведомо чувствительных пациентов, что привело к возможной переоценке эффективности длительного лечения аналогами соматостатина при акромегалии. Кроме того, использование только одного гормонального показателя (СТГ или ИФР-1) в качестве конечной точки также может привести к более высоким показателям эффективности [22].
Помимо антисекреторного эффекта, аналоги соматостатина обладают выраженным антипролиферативным действием за счет ингибирования пролиферации как нормальных, так и опухолевых клеток. Показано, что активация ССР 1, 2, 4 и 5-го подтипов приводит к остановке клеточного цикла, тогда как воздействие на ССР 2-го и 3-го подтипов сопровождается индукцией апоптоза [23]. Действие аналогов соматостатина возможно также опосредованно, за счет снижения продукции фактора роста эндотелия сосудов и подавления ангиогенеза [24]. По данным литературы, уменьшение размеров опухоли наблюдается в 53–85% случаев, что является неоспоримым преимуществом аналогов соматостатина перед другими препаратами для лечения акромегалии [25][26].
Прогноз чувствительности к аналогам соматостатина имеет огромное значение, а выделение пациентов, у которых данная терапия будет успешной, оказывает неоценимую помощь в выборе оптимального метода лечения.
ПРЕДИКТОРЫ РЕЗИСТЕНТНОСТИ К АНАЛОГАМ СОМАТОСТАТИНА ПЕРВОГО ПОКОЛЕНИЯ
Существующие клинические рекомендации определяют критерии эффективности проводимого лечения акромегалии и ремиссии заболевания как достижение уровня ИФР-1, соответствующего полу и возрастной норме, и снижение СТГ <1,0 нг/мл [6]. В литературе имеется несколько подходов к определению понятия «резистентность». Согласно клинической точке зрения, резистентность к медикаментозному лечению трактуется, с одной стороны, как отсутствие нормализации биохимических показателей (СТГ и ИФР-1), с другой — как увеличение размеров опухоли или ее уменьшение менее чем на 20% по сравнению с первоначальным объемом, оцениваемое не раньше чем через 12 мес непрерывного лечения. В случае снижения уровня ИФР-1 более чем на 50% исходного, но без достижения нормализации данного показателя даже на фоне максимальных доз аналогов соматостатина, резистентность можно рассматривать как частичную [27]. Несмотря на то что большинство исследователей сообщают о тесной связи биохимического контроля активности акромегалии с уменьшением размеров опухоли [28], у некоторых пациентов подобной взаимосвязи не наблюдается [29].
В последние годы многие исследования in vitro и in vivo были сосредоточены на выявлении ряда потенциальных клинических, иммуногистохимических и молекулярных маркеров чувствительности и резистентности к терапии аналогами соматостатина (табл. 1) [30][31]. Одними из предикторов эффективности использования данной группы препаратов являются особенности рецепторного фенотипа различных СТГ-секретирующих опухолей гипофиза, изучению которых посвящено наибольшее количество литературных данных. Рецепторы к соматостатину — это семейство G-белок-сопряженных рецепторов, посредством которых соматостатин реализует в организме свои биологические эффекты. К настоящему времени выявлено 5 подтипов ССР (ССР 1–5), которые экспрессируются разными типами клеток нейроэндокринных опухолей, ЖКТ, поджелудочной железы, легких и других локализаций, а также аденомами гипофиза, параганглиомами, менингиомами и некоторыми другими типами опухолей [32].

В исследованиях in vitro было продемонстрировано преимущественное связывание аналогов соматостатина первого поколения с ССР 2-го и в меньшей степени с ССР 5-го подтипа, тогда как аналог соматостатина второго поколения (пасиреотид), наоборот, высокотропен к ССР 4-го и 5-го подтипов [33]. В СТГ-секретирующих опухолях гипофиза также преимущественно выявляются ССР 2-го подтипа более чем в 95% аденом, несколько реже присутствуют ССР 5-го подтипа (85% случаев). ССР 1-го и 3-го подтипов обнаруживаются примерно в 40% соматотропином, в то время как ССР 4-го подтипа практически не встречаются [30, 34]. Предполагается, что активация ССР 2-го и 5-го подтипов является основным механизмом, лежащим в основе подавления секреции СТГ, блокировки пролиферативной активности опухолевых клеток и предотвращения дальнейшего развития патологических изменений [35]. На сегодняшний день разработаны высокоспецифичные кроличьи моноклональные антитела к ССР 2А подтипа (клон UMB-1), а также четкая система оценки их экспрессии, которая достоверно демонстрирует, что высокий уровень экспрессии ССР 2А коррелирует с ответом на лечение аналогами соматостатина [36][37].
Действительно, опухоли с высокой экспрессией ССР 2-го подтипа более чувствительны к терапии аналогами соматостатина, что было доказано в большом количестве исследований. Частота ответа на лечение составляет приблизительно 50–53%, тогда как при низкой экспрессии ССР 2-го подтипа лечение оказывается эффективным только в 15–20% случаев [37][38]. Однако даже при высокой экспрессии ССР 2-го подтипа до 50% пациентов, получающих лечение аналогами соматостатина первого поколения, оказываются резистентными к данной медикаментозной терапии [39]. Одной из причин могут являться точечные генные мутации ССР, способные изменять видовую структуру рецепторного аппарата клеток и, соответственно, их чувствительность к соматостатину [40]. Кроме того, в исследовании Taboada G. и соавт. [41] было предположено, что выявление при иммуногистохимическом исследовании низкого соотношения ССР 2/ССР 5 предсказывает резистентность к терапии аналогами соматостатина первого поколения.
Помимо ССР, гистологическая характеристика соматотропином также определяет чувствительность к аналогам соматостатина. Опухоли, состоящие из плотногранулированных хромофильных (ацидофильных) клеток, преимущественно экспрессируют ССР 2-го подтипа и отличаются наибольшей чувствительностью к аналогам соматостатина первого поколения, тогда как в редкогранулированных и смешанных опухолях гипофиза в большей степени экспрессируются ССР 5-го подтипа, что в силу особенности рецепторного фенотипа объясняет низкую чувствительность к лечению [37]. При сравнении частоты достижения биохимического контроля акромегалии в послеоперационном периоде в зависимости от гистологической характеристики опухоли было показано, что пациенты с плотногранулированными опухолями в 70–90% случаев отвечали на лечение аналогами соматостатина и демонстрировали более выраженное снижение ИФР-1 в сравнении с больными с редкогранулированным типом опухоли по данным иммуногистохимического исследования [37][42].
На сегодняшний день существуют противоречивые данные относительно прогностической ценности индекса пролиферативной активности Ki-67 и ответа на терапию аналогами соматостатина. В нескольких исследованиях было показано, что высокая пролиферативная активность соматотропином связана с низкой чувствительностью к аналогам соматостатина первого поколения [43][44], однако данный вопрос остается предметом обсуждений и не позволяет однозначно рекомендовать использование индекса Ki-67 в качестве предиктивного маркера.
В большинстве проведенных исследований эффективность аналогов соматостатина оценивалась в послеоперационном периоде, однако имеются сообщения о пациентах, подвергшихся нейрохирургическому лечению после длительной терапии аналогами соматостатина. В подобных исследованиях гистологический тип резецированной опухоли коррелировал с предоперационным ответом на терапию аналогами соматостатина [42][45].
Предполагается, что инвазивный рост опухоли, препятствующий возможности ее полной резекции, снижает частоту достижения ремиссии как после нейрохирургического лечения, так и в ответ на терапию аналогами соматостатина. Однако предшествующая лучевая терапия повышает вероятность нормализации ИФР-1 в отдаленном периоде на фоне приема аналогов соматостатина, тогда как влияние на уровень СТГ оказывается незначительным [46].
Наконец, нарушения функции белков, таких как AIP (aryl hydrocarbon receptor-interacting protein), Zac1 (zinc finger protein), RKIP (phosphorylated Raf-kinase inhibitory protein), Е-кадгерин, β-аррестин, участвующих в передаче внутриклеточных сигналов после взаимодействия аналогов соматостатина с ССР, соматические мутации в соматотрофах также могут быть причинами вариабельности ответа на терапию аналогами соматостатина [47]. Зародышевые мутации в гене арильного углеводородного рецептора (AIP) описаны у 15–25% пациентов с семейными изолированными аденомами гипофиза (Familiar Isolated Pituitary Adenomas, FIPA(OMIM#102200)) и у 40–50% семей с акромегалией в рамках гомогенных FIPA семей [48–50]. Потеря гетерозиготности в локусе AIP в тканях удаленных аденом демонстрирует, что ген AIP обладает функцией супрессора опухолевого роста [51]. Пациенты с AIP-ассоциированными аденомами гипофиза — чаще молодые мужчины с редкогранулированными соматотропиномами или смешанными СТГ-пролактин-секретирующими аденомами гипофиза [52]. Примечательно, что аденомы гипофиза у пациентов с мутацией в гене AIP отличаются более агрессивным характером и плохим ответом на терапию. Интересно, что низкая экспрессия белка AIP не связана с резистентностью к пасиреотиду [37], тогда как аналоги соматостатина неэффективны для достижения биохимического контроля и уменьшения размеров опухоли у пациентов с акромегалией и мутацией в гене AIP [51]. Большинству таких пациентов требуются несколько хирургических вмешательств и комбинация нескольких вариантов лечения.
Наличие белка АIP необходимо для экспрессии еще одного опухолевого супрессора — «белка-регулятора цинкового пальца» (Zac1), проявляющего антипролиферативную активность, индуцируя апоптоз и остановку клеточного цикла. В исследовании Theodoropoulou M. и соавт. [53] в группе больных, получавших в предоперационном периоде лечение аналогами соматостатина, обнаружена прямая взаимосвязь как между нормализацией ИФР-1, так и уменьшением размера опухоли на фоне терапии и экспрессией белка Zac1. Таким образом, низкая экспрессия белков AIP и Zac1 могут рассматриваться в качестве предикторов ответа на терапию аналогами соматостатина.
В качестве другого предиктивного маркера при лечении акромегалии можно рассматривать экспрессию белка межклеточной адгезии Е-кадгерина [47]. Проведенные исследования показали, что потеря экспрессии Е-кадгерина приводит к изменению морфологии клеток, увеличению инвазивности опухолевой ткани, размера самой опухоли и резистентности к проводимому лечению аналогами соматостатина [54].
Напротив, низкая экспрессия белка β-аррестина и высокое соотношение ССР 2/β-аррестин коррелируют с чувствительностью соматотропином к длительному лечению аналогами соматостатина у пациентов с акромегалией [31].
К сожалению, большую часть информации об этих факторах можно получить, только исследовав удаленную ткань аденомы гипофиза. Однако не всегда есть возможность получить опухолевую ткань в связи с невозможностью проведения хирургического вмешательства либо категорическим отказом пациента от предложенного нейрохирургического лечения. В подобных случаях возможными предиктивными маркерами эффективности терапии аналогами соматостатина, которые можно оценить у пациентов с акромегалией, не подвергшихся хирургическому лечению, являются пол, возраст, исходные уровни СТГ и ИФР-1, характер сигнала на Т2-взвешенных изображениях при проведении магнитно-резонансной томографии (МРТ) головного мозга [39]. В исследовании Gatto F. и соавт. [31] было показано, что более молодые пациенты мужского пола, а также пациенты с исходно более высокими показателями СТГ и ИФР-1 чаще резистентны к терапии аналогами соматостатина.
В ряде исследований было продемонстрировано, что аденомы гипофиза с гипоинтенсивным МР-сигналом на Т2-взвешенных изображениях при электронной микроскопии оказываются обычно плотногранулированными аденомами и отличаются высокой чувствительностью к терапии аналогами соматостатина в отличие от аденом, гиперинтенсивных на Т2-взвешенных изображениях, которые, как правило, являются редкогранулированными и резистентны к терапии [55]. Кроме того, редкогранулированные аденомы гипофиза чаще представлены макроаденомами и могут проявлять более агрессивное течение.
В настоящее время короткий тест с октреотидом, предложенный еще в 1988 г. с целью решения вопроса о количестве подкожных инъекций октреотида короткого действия в сутки, имеет спорное прогностическое значение, однако может быть использован в совокупности с другими предикторами. Снижение ИФР-1 менее чем на 30% от исходного уровня через 3 дня введения октреотида короткого действия подкожно в дозе 100 мкг 3 раза в сутки свидетельствует о резистентности данного пациента к терапии аналогами соматостатина, тогда как снижение уровня ИФР-1 более чем на 60% с высокой вероятностью предсказывает чувствительность больного к данной терапии [56].
СПОСОБЫ ПРЕОДОЛЕНИЯ РЕЗИСТЕНТНОСТИ К АНАЛОГАМ СОМАТОСТАТИНА
На сегодняшний день существует несколько терапевтических вариантов повышения эффективности терапии аналогами соматостатина (см. рис. 1). Стандартная стартовая доза пролонгированных препаратов октреотида составляет 20 мг 1 раз в 28 дней, ланреотида — 90 мг ежемесячно с возможностью снижения дозы до 60 мг или повышения до 120 мг. При неэффективности терапии через 3–6 мес возможно увеличение дозы октреотида до 3 или 40 мг. В исследовании Colao А. и соавт. [57] увеличение дозы октреотида до 40 мг/28 дней способствовало нормализации уровня ИФР-1 и достижению биохимического контроля заболевания у 35% пациентов с частичной резистентностью к аналогам соматостатина. Эффективность и безопасность сокращения интервала между инъекциями до 21 дня или увеличения дозы октреотида пролонгированного действия до 60 мг/28 дней была изучена в многоцентровом открытом рандомизированном исследовании. Применение октреотида ЛАР® в высоких дозах (60 мг/28 дней) способствовало выраженному снижению уровня ИФР-1 в 90% случаев в сравнении с группой пациентов, получавших лечение в дозе 30 мг/21 день (р<0,05) [58]. Таким образом, сокращение интервала между введением препарата отличается меньшей эффективностью в достижении биохимического контроля заболевания в сравнении с увеличением дозы препарата.
Недавнее исследование Giustina А. и соавт. [59] показало, что повышение дозы ланреотида Аутожеля® (180 мг/28 дней) и более частый прием препарата (120 мг/21 день) нормализуют уровни ИФР-1 примерно у 30% пациентов с акромегалией, не поддающихся контролю заболевания стандартными дозами. Однако наибольшей эффективностью обладал режим увеличения дозы в сравнении с сокращением интервала между инъекциями.
Таким образом, повышение дозы октреотида пролонгированного действия или уменьшение межинъекционных интервалов при лечении ланреотидом пролонгированного действия может помочь достичь биохимического контроля заболевания. При выраженной резистентности возможна внутригрупповая замена октреотида на ланреотид или пасиреотид «off-label» [60].
АНАЛОГИ СОМАТОСТАТИНА ВТОРОГО ПОКОЛЕНИЯ
Пасиреотид — мультилигандный аналог природного соматостатина длительного действия, воздействующий на ССР 1–3-го и ССР 5-го подтипов. В исследованиях in vitro было показано, что пасиреотид обладает в 40, 30 и 5 раз более высокой связывающей способностью с ССР 5, ССР 1 и ССР 3 подтипами соответственно в сравнении с октреотидом [61]. Благодаря этому применение пасиреотида может оказаться эффективным у пациентов, резистентных к аналогам соматостатина первого поколения, тогда как чувствительность к препарату коррелирует с экспрессией ССР 5-го подтипа в опухолевых клетках, что было продемонстрировано в работе Iacovazzo D. и соавт. [37] (см. табл. 1).
В проспективном рандомизированном двойном слепом исследовании применение пасиреотида в дозе 40 мг/28 дней у пациентов с акромегалией продемонстрировало значительно более высокую эффективность по сравнению с октреотидом пролонгированного действия (20 мг/28 дней) в достижении биохимического контроля заболевания (31,3% против 19,2%, р=0,007), однако оба препарата показали одинаковую эффективность в достижении безопасных уровней СТГ (48,3% в группе пасиреотида и 51,6% при приеме октреотида, р=0,002) [62]. Основным недостатком пасиреотида являются нарушения углеводного обмена, которые наблюдаются в 57–67% случаев [62][63].
В другом многоцентровом ретроспективном исследовании с участием 35 пациентов в активной стадии акромегалии, получавших лечение аналогами соматостатина первого поколения, 19 (54%) больных, резистентных к проводимому медикаментозному лечению, достигли нормализации уровней ИФР-1 после перехода на лечение пасиреотидом. Однако у 63% пациентов на фоне лечения пасиреотидом наблюдались нарушения углеводного обмена [64].
Несмотря на удовлетворительную переносимость, назначение пасиреотида при акромегалии ограничено ввиду выраженных нарушений углеводного обмена, требующих подбора рациональной сахароснижающей терапии. Его использование возможно «off-label» в ограниченных случаях в качестве медикаментозной терапии второй линии при полной резистентности к аналогам соматостатина первого поколения [60] (см. рис. 1).
В клинической практике нередки случаи, когда применение аналогов соматостатина в максимальных дозах не позволяет достичь биохимического контроля или проявляется в виде небезопасных побочных эффектов. В подобных ситуациях возможна комбинация одного из препаратов группы аналогов соматостатина с агонистами дофамина «off-label» или с антагонистом рецепторов гормона роста — пэгвисомантом «off-label».
АГОНИСТЫ ДОФАМИНА, ИСПОЛЬЗУЕМЫЕ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Агонисты дофамина — первые лекарственные препараты, которые применяются в лечении больных акромегалией с 1974 г. Несмотря на то что у здоровых людей введение агонистов дофаминовых рецепторов стимулирует выброс СТГ, у пациентов с акромегалией прием данных препаратов сопровождается парадоксальным снижением его секреции. Эффективность данной группы препаратов при лечении акромегалии связывают с экспрессией дофаминовых D2-рецепторов в соматотропиномах. В зависимости от действия на дофаминовые D2-рецепторы выделяют неселективные — бромокриптин и селективные агонисты — хинаголид и каберголин, отличающиеся большей эффективностью при меньшей кратности приема и большей специфичностью к дофаминовым рецепторам [65].
Согласно литературным данным, монотерапия каберголином позволяет достичь нормализации уровней ИФР-1 лишь у 30% пациентов с акромегалией, тогда как комбинация каберголина с аналогами соматостатина повышает вероятность достижения биохимической ремиссии до 40–50% [66].
Многочисленные исследования показали, что, вопреки имевшемуся ранее представлению, чувствительность к каберголину не зависит от уровня пролактина до начала лечения [67]. Единственным предиктором эффективности терапии агонистами дофамина при акромегалии является исходный уровень ИФР-1, в идеале не превышающий верхнюю границу референсного интервала более чем в полтора раза, что значительно увеличивает шансы достичь ремиссии заболевания на фоне лечения каберголином [7] (см. табл. 1).
Учитывая большую доступность каберголина, в том числе с экономической точки зрения, в сравнении с пэгвисомантом, комбинация каберголина с октреотидом или ланреотидом может быть рассмотрена при выявлении неадекватной чувствительности пациента к аналогам соматостатина (см. рис. 1). Назначение каберголина в качестве монотерапии при акромегалии возможно «off-label» только у пациентов с низкой активностью заболевания или при смешанных СТГ-пролактин-секретирующих аденомах гипофиза со значительным повышением концентрации пролактина и умеренной гиперпродукцией СТГ [68][69].
АНТАГОНИСТ РЕЦЕПТОРА ГОРМОНА РОСТА В ЛЕЧЕНИИ АКРОМЕГАЛИИ
Важной опцией при отсутствии контроля акромегалии является применение пэгвисоманта. Данный препарат представляет собой генно-инженерную модифицированную молекулу человеческого гормона роста и обладает высокой селективностью в отношении рецепторов СТГ, не взаимодействуя с рецепторами других цитокинов, включая пролактин. Подавление биологического действия нативного гормона роста в периферических тканях и органах сопровождается снижением сывороточных концентраций ИФР-1 и других белков, ответственных за СТГ-опосредованное действие [70]. Пэгвисомант позволяет достичь нормализации уровня ИФР-1, по разным данным, у 65–95% пациентов с акромегалией [71–73]. Его эффективность не зависит от экспрессии дофаминовых или соматостатиновых рецепторов в соматотропиноме, следовательно, его применение возможно при резистентности к аналогам соматостатина (см. рис. 1). Однако, в отличие от аналогов соматостатина, пэгвисомант не оказывает положительного влияния на аденому гипофиза, но и не увеличивает достоверно объем опухоли, хотя потенциально может способствовать ее росту, что преимущественно наблюдается у лиц без предшествующей лучевой терапии в анамнезе или после отмены аналогов соматостатина (ребаунд-эффект) [74]. Интересно, что изменение объема опухоли не коррелирует с уровнем ИФР-1 [75].
Эффективность препарата не зависит от предшествующего вида лечения, однако повышается по мере титрации дозы. Стартовая доза и скорость титрации должны быть более высокими у молодых пациентов, у больных сахарным диабетом и лиц с избыточной массой тела [76, 77]. К факторам, ассоциированным с лучшим ответом на лечение пэгвисомантом, относятся мужской пол, низкий индекс массы тела, более низкие значения ИФР-1 на момент постановки диагноза, предшествующая лучевая терапия и отсутствие нарушений углеводного обмена [77][78] (см. табл. 1). Несмотря на то что пэгвисомант оказывает благоприятное влияние на углеводный обмен и может быть полезен пациентам с акромегалией и диагностированным ранее сахарным диабетом или нарушением гликемии натощак [79], нормализация уровня ИФР-1 у таких пациентов происходит несколько реже в сравнении с пациентами без нарушений углеводного обмена (64% против 75%), в связи с чем необходимо назначение более высоких доз пэгвисоманта для контроля заболевания [80].
Согласно международным консенсусам, пэгвисомант показан в качестве терапии второй или третьей линии и обычно не используется в качестве первичной монотерапии, а только в комбинации с хирургическим, лучевым методами лечения, совместно с аналогами соматостатина или в качестве монотерапии при нечувствительности пациентов или плохой переносимости терапии аналогами соматостатина, либо в случае, если на фоне лечения аналогами соматостатина ухудшается течение сахарного диабета [81–83]. По данным литературы, пэгвисомант значимо (примерно на 75%) снижает уровень ИФР-1 уже через 2 нед терапии и в 85% случаев позволяет достичь нормализации ИФР-1 при правильной титрации дозы [79].
В исследовании Neggers S.J. и соавт. [84] добавление пэгвисоманта к терапии аналогами соматостатина привело к нормализации уровня ИФР-1 у 97% больных акромегалией, резистентных к лечению аналогами соматостатина в максимально разрешенных дозах. Преимуществами подобной комбинации являются возможность снижения дозы одного из препаратов примерно на 50% в сравнении с монотерапией и уменьшение частоты инъекций, что значительно повышает комплаентность пациентов [85]. В работе van der Lely и соавт. [86] были продемонстрированы сходные результаты, доказав, что монотерапия пэгвисомантом эффективна в отношении нормализации ИФР-1 у 88% пациентов, резистентных к аналогам соматостатина. Добавление пэгвисоманта к терапии аналогами соматостатина способствует дальнейшему снижению ИФР-1, а также уменьшает риск увеличения объема опухоли. Кроме того, комбинированная терапия аналогами соматостатина длительного действия и пэгвисомантом в большинстве случаев позволяет нормализовать нарушения углеводного обмена, оказывает благоприятное влияние на сердечно-сосудистую систему, однако подобная комбинация не зарегистрирована для лечения акромегалии и является назначением «off-label» [76][84].
На сегодняшний день в литературе имеется ограниченное количество исследований, посвященных изучению комбинации пэгвисоманта с каберголином. Результаты проспективного исследования Higham C.E. и соавт. [87] показали, что комбинированное использование пэгвисоманта в низких дозах (10 мг/сут) и каберголина (0,5 мг/сут) приводит к нормализации ИФР-1 у 68% пациентов. Лучший ответ на комбинированную терапию наблюдался у лиц женского пола с более низкой массой тела и исходным уровнем ИФР-1, а также более высокими концентрациями пролактина. Интересно, что после отмены каберголина только у 26% больных сохранялся уровень ИФР-1 в пределах референсного интервала, позволяя предположить большую эффективность комбинированной терапии в сравнении с монотерапией любым из данных препаратов.
Эффективность пэгвисоманта в качестве первичной медикаментозной терапии акромегалии систематически не изучалась. Последние клинические руководства и международные консенсусные соглашения рассматривают возможность назначения пэгвисоманта в качестве препарата первой линии при сочетании акромегалии с синдромом Мак-Кьюна–Олбрайта, но не для лечения акромегалии в целом [81][82][88]. Недавнее исследование Tritos N.A. и соавт. [89] было посвящено оценке эффективности пэгвисоманта у пациентов с акромегалией, ранее не получавших какого-либо лечения заболевания, в сравнении с пациентами, которым назначалась монотерапия пэгвисомантом после нейрохирургического вмешательства. Монотерапия пэгвисомантом оказалась одинаково эффективной в отношении нормализации уровней ИФР-1 более чем у 75% пациентов в обеих группах, однако дозы препарата в группе пациентов, которым пэгвисомант назначался в качестве терапии первой линии, были достоверно выше (p=0,03). Примечательно, что ни у одного из пациентов, получавших пэгвисомант в качестве монотерапии первой линии, не было зарегистрировано увеличения объема опухоли, однако 35,7% пациентов из данной группы потребовалось в дальнейшем хирургическое вмешательство в качестве дополнительного лечения. Независимо от того, назначался ли пэгвисомант в качестве метода лечения первой или второй линии, высокий уровень ИФР-1 перед началом лечения и наличие сахарного диабета значительно снижали вероятность достижения биохимической ремиссии заболевания при монотерапии пэгвисомантом, что согласуется с литературными данными [77][78].
Таким образом, пэгвисомант высокоэффективен в отношении достижения биохимического контроля заболевания, однако его назначение в качестве первичной монотерапии при лечении акромегалии ограничено инструкцией к препарату и считается применением «off-label». Согласно инструкции, пэгвисомант рекомендуется для лечения пациентов с акромегалией в случае отсутствия адекватного ответа на хирургическое лечение и/или лучевую терапию и при отсутствии нормализации концентрации ИФР-1 на фоне терапии аналогами соматостатина или при непереносимости данной группы лекарственных средств.
ВЛИЯНИЕ МЕДИКАМЕНТОЗНОЙ ТЕРАПИИ АКРОМЕГАЛИИ НА УГЛЕВОДНЫЙ ОБМЕН
Помимо характерных изменений внешности, хроническая избыточная секреция гормона роста сопровождается нарушениями со стороны различных органов и систем, в том числе приводит к значительным метаболическим изменениям. Прямой контринсулярный эффект СТГ усиливает инсулинорезистентность периферических тканей, активирует липолиз, стимулирует глюконеогенез и гликогенолиз в печени, что вызывает гипергликемию и развитие симптоматического сахарного диабета на фоне акромегалии [90]. Распространенность сахарного диабета при акромегалии, по разным данным, составляет 16–56%, нарушение толерантности к глюкозе встречается в 6–45% случаев, нарушение гликемии натощак — в 7–22% [91]. Нарушения углеводного обмена, так же, как и необходимость введения экзогенного инсулина, быстро исчезают на фоне снижения концентрации СТГ после хирургического вмешательства, тогда как медикаментозная терапия акромегалии оказывает различное влияние на метаболизм глюкозы (табл. 2) [92].
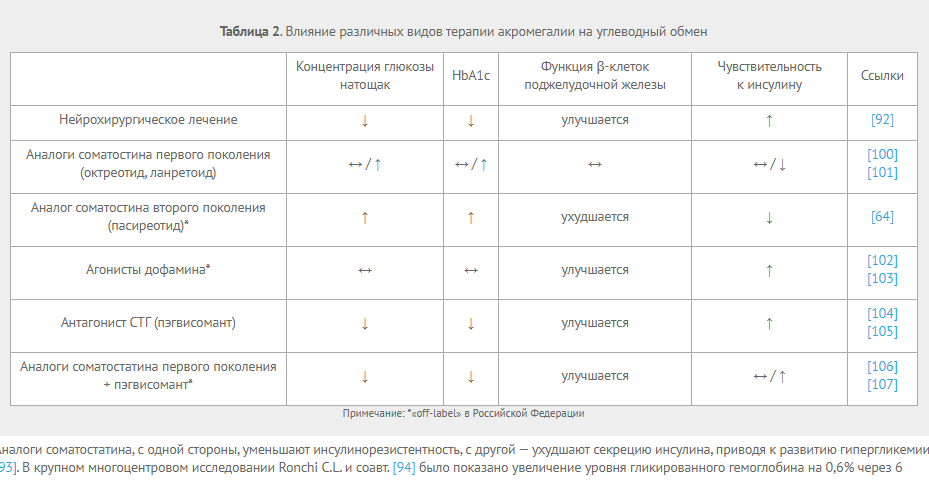
Аналоги соматостатина, с одной стороны, уменьшают инсулинорезистентность, с другой — ухудшают секрецию инсулина, приводя к развитию гипергликемии [93]. В крупном многоцентровом исследовании Ronchi C.L. и соавт. [94] было показано увеличение уровня гликированного гемоглобина на 0,6% через 6 мес от начала лечения аналогами соматостатина первого поколения.
В отличие от аналогов соматостатина первого поколения, пасиреотид (аналог соматостатина второго поколения) подавляет преимущественно секрецию инсулина и инкретинов, таких как глюкагоноподобный пептид-1 и глюкозозависимый инсулинотропный полипептид, и в меньшей степени влияет на секрецию глюкагона [95]. Подобное объясняется более высокой связывающей способностью пасиреотида с ССР 5-го подтипа, играющими важную роль в регуляции секреции инсулина, и более низким сродством к ССР 2-го подтипа, регулирующим секрецию глюкагона [96]. По данным Hannon A.M. и соавт. [97], частота развития нарушений углеводного обмена на фоне лечения пасиреотидом составляет 65–71%.
В случае развития резистентности к аналогам соматостатина переход на монотерапию пэгвисомантом улучшает чувствительность периферических тканей к инсулину, снижает концентрацию глюкозы натощак примерно на 50%, уровень гликированного гемоглобина и индекс HOMA-I у больных акромегалией с ранними нарушениями углеводного обмена и сахарным диабетом [98]. Благодаря улучшению гликемического профиля на фоне терапии пэгвисомантом значительно снижается потребность в сахароснижающих препаратах [99]. В исследовании Higham C.E. и соавт. [71] перевод пациентов с наличием или отсутствием нарушений углеводного обмена с терапии аналогами соматостатина на пэгвисомант сопровождался снижением уровня гликированного гемоглобина и глюкозы натощак. Положительное влияние пэгвисоманта на углеводный обмен также сохраняется в комбинации с аналогами соматостатина, однако в России данная комбинация является назначением «off-label» [84].
Таким образом, нормализация уровня СТГ улучшает углеводный обмен и увеличивает чувствительность к инсулину вне зависимости от вида используемой терапии в лечении. Лечение акромегалии аналогами соматостатина оказывает негативное влияние на углеводный обмен и нередко требует подбора рациональной сахароснижающей терапии. Напротив, антагонист рецептора гормона роста (пэгвисомант) улучшает показатели углеводного обмена и может быть рекомендован пациентам с нарушениями углеводного обмена и/или декомпенсацией углеводного обмена на фоне лечения аналогами соматостатина в качестве альтернативной терапии.
ЗАКЛЮЧЕНИЕ
Проблема резистентности к терапии у пациентов с акромегалией является достаточно распространенной в клинической практике и требует персонализированного подхода с учетом различных клинико-морфологических, молекулярно-генетических и лабораторных предикторов чувствительности к выбору метода лечения. На сегодняшний день аналоги соматостатина первого поколения в большинстве случаев являются препаратами первой линии в медикаментозном лечении акромегалии, однако до 50% пациентов не достигают биохимической ремиссии на фоне терапии. Одним из возможных путей преодоления резистентности является увеличение дозы октреотида или уменьшение межинъекционных интервалов при лечении ланреотидом, а также внутригрупповая замена октреотида на ланреотид. Благодаря созданию и внедрению в клиническую практику новых лекарственных препаратов, в первую очередь антагониста рецептора гормона роста — пэгвисоманта, значительно расширились возможности и эффективность лечения пациентов с акромегалией, резистентных к аналогам соматостатина. В случаях выраженной резистентности или плохой переносимости аналогов соматостатина для достижения нормализации уровня ИФР-1 показано добавление пэгвисоманта. Необходимо дальнейшее изучение возможности применения пэгвисоманта в качестве терапии первой линии и проведение дополнительных проспективных исследований.