А.С. Луценко*, Е.В. Нагаева, Ж.Е. Белая,
О.С. Чухачева, Т.С. Зенкова, Г.А. Мельниченко
Национальный медицинский исследовательский
центр эндокринологии
Введение
Дети с установленным дефицитом гормона роста получают заместительную терапию рекомбинатным гормоном роста до совершеннолетия и достижения генетически прогнозируемого конечного роста.
Несмотря на то, что основной спектр физиологических эффектов соматотропный гормон (СТГ) оказывает на организм в детском возрасте, а в последующем его выработка снижается, СТГ играет важную роль в нормальном функционировании органов и систем взрослого человека. В настоящее время в России разработана система оказания медицинской помощи детям с дефицитом гормона роста [1, 2], однако отсутствуют клинические рекомендации, посвященные диагностике и заместительной терапии СТГ-дефицита взрослых.
Первые исследования, посвященные лечению СТГ-дефицита у взрослых пациентов с гипопитуитаризмом, были опубликованы в 1989 г. [3, 4]. В Российской Федерации первый опыт применения человеческого гормона роста у взрослых пациентов с СТГ-дефицитом был опубликован в 2004 г. [5]. Клинические проявления заболевания у взрослых пациентов неспецифичны и в случаях приобретенного СТГ-дефицита часто маскируются проявлениями недостаточностей других тропных гормонов гипофиза, что затрудняет диагностику.
Целью данного обзора является обобщение современных данных по диагностике, лечению и системному влиянию заместительной терапии соматропином у взрослых пациентов с СТГ-дефицитом.
Клинические проявления
Дефицит СТГ у взрослых характеризуется системными изменениями метаболизма при неспецифичных клинических проявлениях [6].
- Состав тела. Увеличение массы жировой ткани, преимущественно за счет висцерального жира, уменьшение тощей массы [7–9], снижение объема внеклеточной жидкости и общей концентрации натрия [10].
- Физическая активность. Снижение толерантности к физическим нагрузкам, уменьшение мышечной силы на фоне уменьшения количества мышечной ткани [11]. Нарушение терморегуляции [12].
- Сердечно-сосудистая система, липидный обмен и система свертывания крови. Увеличение сердечно-сосудистого риска за счет дислипидемии, нарушений углеводного обмена и ускоренного развития атеросклероза. Уменьшение массы миокарда, нарушение проводимости, сократимости и ударного объема, снижение нагнетательной функции и фракции выброса, диастолическая дисфункция [13]. Дислипидемия вследствие повышения концентрации общего холестерина, холестерина ЛПНП и триглицеридов [14]. Повышение активности фибриногена и ингибитора активаторов плазминогена 1-го типа (PAI-1) [15].
- Углеводный обмен. Нарушение толерантности к глюкозе, инсулинорезистентность [16].
- Костная система. Уменьшение костной массы и минеральной плотности кости (МПК), повышение риска переломов [17–19].
- Качество жизни и когнитивные функции. Снижение качества жизни: дезадаптация, сниженная самооценка, тревожность, апатия, депрессия, социальная изоляция [20].
Диагностика
Диагностика СТГ-дефицита взрослых сложна по ряду причин. Клинические проявления данного заболевания неспецифичны и потому имеют невысокую диагностическую ценность [21]. В физиологических условиях секреция СТГ имеет импульсный характер, на нее влияют возраст, пол и индекс массы тела, в связи с чем определение базальной концентрации СТГ не имеет диагностического значения [22].
Нормальные показатели ИРФ-1 сыворотки крови не исключают диагноз СТГ-дефицита. ИРФ-1, ИРФ-связывающий белок 3 (ИРФСБ-3) имеют ориентировочное значение для диагностики, поскольку показатели у пациентов с СТГ-дефицитом и здоровых людей могут частично совпадать [23].
В настоящее время общепринятым методом диагностики СТГ-дефицита взрослых являются стимуляционные пробы [22, 24], протоколы которых представлены в табл. 1.

Зарубежные клинические руководства рекомендуют проводить пробы только тем пациентам, у козаместительная гормональная терапия соматотропином будет способствовать улучшению метаболических параметров и качества жизни. Проведения провокационных проб не требуется при наличии одного из двух условий:
1. Наличие трех из четырех составляющих:
– значительный дефицит роста (<-3 SDS);
– как минимум одна дополнительная тропная недостаточность;
– низкая концентрация ИФР-1 в крови;
– врожденный дефект гипоталамо-гипофизарной области по данным МРТ: «триада» (гипоплазия аденогипофиза, эктопия нейрогипофиза, аплазия/гипоплазия ножки гипофиза);
или
– оперативное лечение опухоли гипоталамо-гипофизарной области в анамнезе;
или
– облучение области «голова–шея» в анамнезе.
2. Мутации генов, ассоциированных с развитием гипопитуитаризма: GH1, GHRHR, HESX1, LHX3, PROP1, POU1F1 [PIT1] и др. [22, 24, 25].
В табл. 2 представлены используемые в мире пороговые значения диагностических проб для диагностики СТГ дефицита у взрослых.
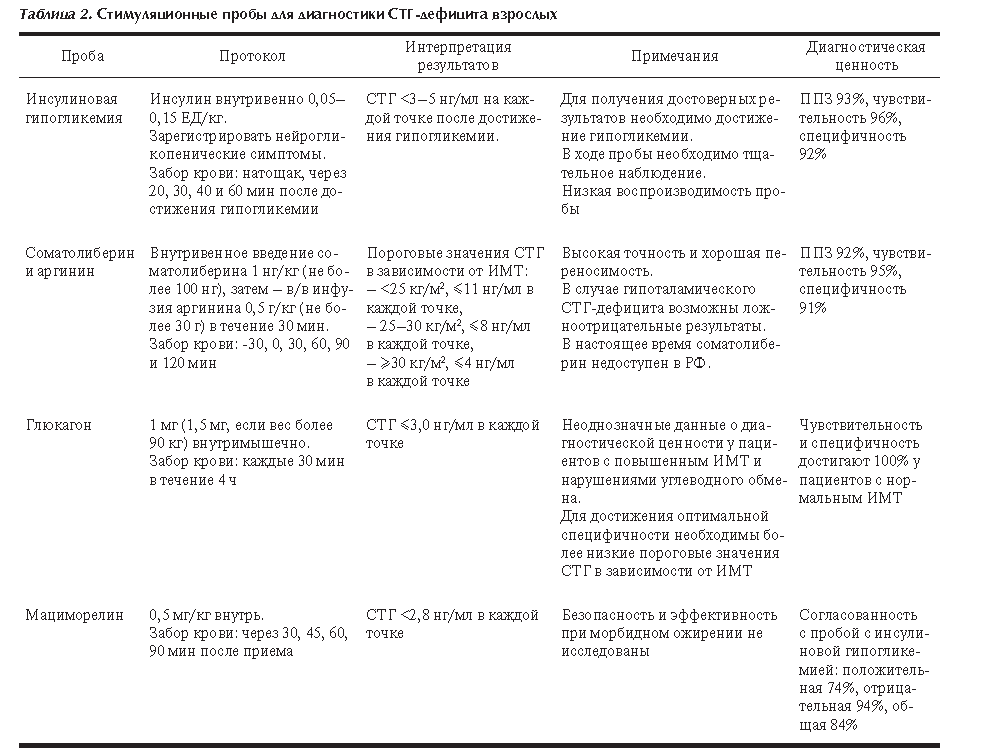
Проба с инсулиновой гипогликемией Стимуляция секреции СТГ при гипогликемии была впервые описана в 1963 г. [26]. Данная проба считается «золотым стандартом» в диагностике СТГ-дефицита взрослых [22, 24], однако у нее имеется ряд недостатков. Требуется тщательное медицинское наблюдение для мониторинга потенциальных нежелательных явлений (судорожных приступов или потери сознания вследствие гипогликемии). Кроме того, в связи с наличием инсулинорезистентности у пациентов с ожирением, у данной категории может понадобиться использование более высоких доз инсулина (0,15–0,20 ЕД/кг массы тела), что увеличивает риск отсроченной гипогликемии [27]. Проба с инсулиновой гипогликемией противопоказана пожилым пациентам, лицам с высоким сердечно-сосудистым риском и эпилепсией. И хотя чувствительность пробы высока, отмечаются ограничения в ее воспроизводимости. Кроме того, вариабельность пиков секреции СТГ отмечалась у здоровых добровольцев в зависимости от времени проведения и в разные фазы менструального цикла [22].
В настоящее время в качестве диагностического значения стимулированной секреции СТГ при гипогликемии используется диапазон 3,0–5,0 нг/мл [22, 24].
Согласно зарубежным рекомендациям, при противопоказаниях к пробе с инсулиновой гипогликемией возможно проведение комбинированной пробы со стимуляцией соматолиберином и аргинином, однако, применение аргинина для диагностики СТГ-дефицита в РФ не зарегистрировано.
Проба с соматолиберином и аргинином
Проба с соматолиберином и аргинином, как и проба с инсулиновой гипогликемией, считается достаточно чувствительной и специфичной для диагностики СТГ-дефицита [28, 29], однако в настоящее время на фармацевтическом рынке отсутствует препарат соматолиберина.
Точность данной пробы определяется совместным применением двух стимулирующих веществ: соматолиберин стимулирует синтез и высвобождение СТГ гипофизом [30], а аргинин усиливает этот эффект путем подавления высвобождения соматостатина [31]. Концентрация СТГ на фоне стимуляции не зависит от пола и возраста, однако, результат зависит от ИМТ, в связи с чем используются три пороговых значения (табл. 3).
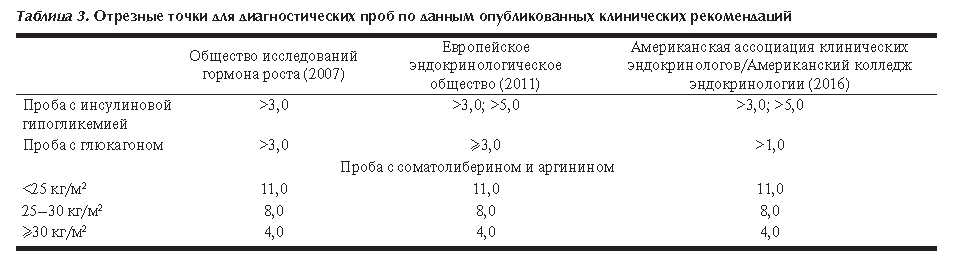
В связи с тем, что в ходе данной пробы стимулируется и гипофиз, и гипоталамус, при гипоталамическом генезе заболевания (например, после лучевой терапии) возможны ложноположительные результаты [32].
Проба с глюкагоном
В связи с тем, что основная альтернативная проба для диагностики недоступна, активно изучается возможность применения пробы с глюкагоном при противопоказаниях к пробе с инсулиновой гипогликемией.
Глюкагон – сильный стимулятор секреции СТГ, однако, механизм стимуляции остается неясным.
Стимулирующий эффект более выражен при внутримышечном или подкожном введении по сравнению с внутривенным [33].
Достоинства пробы с глюкагоном – воспроизводимость и безопасность, на ее результаты не влияет пол и гипоталамический генез СТГ-дефицита. Недостатки – длительность пробы (3–4 ч) и необходимость внутримышечного введения глюкагона. Побочные эффекты пробы более выражены у пожилых пациентов: гипотония, гипогликемии и приступы эпилепсии [34]. Кроме того, имеется риск отсроченных гипогликемий, в связи с чем данная проба не вошла в рутинную клиническую практику.
В двух исследованиях сравнивались диагностические возможности пробы с глюкагоном и пробы с инсулиновой гипогликемией, группы пациентов и контроль были сопоставлены по полу и возрасту [35, 36]. В исследовании J. Gómez и соавт. группы пациентов были также сопоставлены по ИМТ, в данном исследовании выявлена обратная корреляция возраста и ИМТ с пиковыми концентрациями СТГ у здоровых добровольцев.
Изначально пороговым значением концентрации СТГ принималось 3,0 нг/мл. В дальнейших исследованиях выявлено, что использование такого значения приводит к гипердиагностике СТГ-дефицита [37]. Принимая это во внимание, рекомендации Американской ассоциации эндокринологов предлагают использовать пороговое значение 1,0 нг/мл для пациентов с ИМТ более 25 кг/м2. Авторы также отмечают, что для уточнения диагностической точности сниженного порогового значения необходимо проведение больших проспективных исследований среди пациентов с различным ИМТ и нарушениями углеводного обмена [22].
Секретагоги гормона роста
К данному классу относятся молекулы, проявляющие сильный дозозависимый и специфичный стимуляционный эффект на соматотрофы [38]. Они связываются с рецептором СТГ секретагога-1а (growth hormone secretagogue receptor 1a, GHS-R1a) в гипоталамусе и гипофизе. Естественным лигандом данного рецептора является грелин [39]. Другие агонисты его рецептора являются аналогами грелина: GHRP-2 (GH-releasing peptide-2, СТГ-рилизинг пептид-2), GHRP-6, гексарелин, все данные вещества вводятся парентерально. Также существуют аналоги грелина для перорального введения.
Достоинство секретагогов СТГ – возможность перорального приема [40]. Они устойчивы к протеолизу, так как многие представители являются небелковыми молекулами либо содержат D-изомеры аминокислот [41]. Недостаток – возможность получения ложноположительных результатов при гипоталамическом генезе СТГ-дефицита [42].
Проводились исследования, оценивающие диагностическую ценность проб с GHRP-6, GHRP-2 и комбинаций соматолиберина с гексарелином, пиридостигмином, аципимоксом, GHRP-6 в сравнении с пробой с инсулиновой гипогликемией [43–48].
В исследованиях теста с соматолиберином и GHRP-6 для диагностики СТГ-дефицита взрослых отмечена хорошая переносимость пробы (единственный побочный эффект – «приливы»), высокая чувствительность и воспроизводимость. GHRP-6 назначается внутривенно, пик ответа СТГ развивается на 15–30-й минуте – значительно раньше, чем при использовании других фармакологических стимуляторов. Пороговое значение для нормального ответа 20 нг/мл, для СТГ-дефицита 10 нг/мл [49, 50]. На результаты данного теста не влияют возраст, пол или избыточная масса тела, за исключением случаев, когда ИМТ превышает 35 кг/м2, – пороговое значение снижается до 5 нг/мл [51].
Пробу с GHRP-2 с 2006 г. используют в Японии, так как она безопасна и удобна, в качестве порогового значения используется концентрация СТГ 9 нг/мл.
Пиковой концентрации СТГ после стимуляции достигает на 60-й минуте [52].
В исследовании, где в качестве стимулирующего агента использовался ацетилированный грелин, наиболее диагностически значимыми значениями концентрации СТГ для диагностики были 7,3 нг/мл при нормальной массе тела, 2,9 нг/мл при избыточной массе тела и 0,6 нг/мл при ожирении, диагностическая точность составила 89,3, 94,1 и 62,5% соответственно. Авторы делают вывод, что ожирение значительно снижает ответ СТГ на стимуляцию грелином, однако данная проба является надежным инструментом в диагностике у пациентов с нормальной и избыточной массой тела [53].
В настоящее время применение вышеуказанных методов в Российской Федерации невозможно, так как на рынке отсутствуют препараты соматолиберина и секретагогов СТГ.
Пероральный секретагог СТГ
В 2017 г. Food and Drugs Administration (FDA) одобрило применение мациморелина для диагностики СТГ-дефицита у взрослых [54].
Мациморелин – агонист GHS-R1a с высокой стабильностью, которая позволяет назначать его перорально. В исследовании I фазы у 36 здоровых добровольцев при пероральном приеме мациморелина отмечалось быстрое дозозависимое повышение концентрации препарата в плазме, пик концентрации достигался на 50–75-й минуте после приема. Дозозависимая стимуляция секреции СТГ соотносилась по времени с максимальной концентрацией препарата в плазме, повышение концентрации СТГ длилось около 120 мин после перорального приема или интрадуоденального введения. Препарат хорошо переносился, нежелательных явлений не выявлено [55].
В многоцентровом открытом исследовании сравнивали диагностическую ценность и безопасность мациморелина в сравнении с пробой соматолиберин + аргинин, среди взрослых пациентов с СТГ-дефицитом и здоровых добровольцев. Согласно ROC-анализу, оптимальная пороговая концентрация СТГ составила 2,7 нг/мл: чувствительность 82%, специфичность 92%, доля ошибок в распознавании 13%. Среди пациентов, которым назначали оба диагностических теста, диагностическая ценность методов была сопоставима.
Пиковые концентрации СТГ обратно коррелировали с ИМТ в контрольной группе. При единственном заборе крови через 45 мин после приема мациморелина, при использовании пороговых значений, согласно ИМТ (6,8 нг/мл при ИМТ <30 кг/м2, 2,7 нг/мл при ИМТ ≥30 кг/м2) чувствительность пробы составила 90%, специфичность – 85%, доля ошибок в распознавании – 12,2% [56].
В 2018 г. опубликованы результаты многоцентрового, открытого, рандомизированного, двойного перекрестного исследования, целью которого было установить эффективность и безопасность применения однократного приема мациморелина в дозе 0,5 мг/кг для диагностики СТГ-дефицита взрослых, по сравнению с пробой с инсулиновой гипогликемией.
Пациенты были поделены на три группы согласно вероятности наличия заболевания: высокой (n=38), средней (n=37) и низкой (n=39), также подобрана группа здоровых добровольцев (n=25).
При использовании в качестве «точки отсечения» значения концентрации СТГ 2,8 нг/мл для мациморелина и 5,1 нг/мл для пробы с инсулиновой гипогликемией, отрицательная согласованность составила 95,38% (95% ДИ 87–99%), положительная согласованность – 74,32% (95% ДИ 63–84%), чувствительность 87%, специфичность 96%. Воспроизводимость пробы с мациморелином составила 97% (n=33). В ходе вторичного анализа выявлено, что использование отрезной точки 5,1 нг/мл позволяет достигнуть отрицательной согласованности 94% (95% ДИ 85–98%), положительной согласованности 82% (95% ДИ 72–90%), чувствительности 92% и специфичности 96% [57].
В настоящее время не опубликовано результатов по безопасности и диагностической ценности данного теста у пациентов с морбидным ожирением. К наиболее частым побочным эффектам относятся искаляемость и нарушения работы желудочно-кишечного тракта (тошнота, голод и диарея). Следует избегать назначения совместно с препаратами, удлиняющими интервал QT, так как это может привести к развитию желудочковой тахикардии. CYP3A4 – основной фермент, метаболизирующий мациморелин, поэтому при применении совместно с препаратами, активирующими его, возможно получение ложноположительных результатов [54].
Стандартизация наборов для определения СТГ Результаты стимулирующих проб трактуются согласно пороговым значениям концентраций, в связи с чем точность лабораторного определения СТГ крайне важна.
Циркулирующий СТГ представлен различными изоформами и изомерами: в наибольшей доле присутствует вариант массой 22 кДа, также присутствуют молекулы меньшей массы. Моноклональные антитела способны специфично связываться с изоформами массой 22 кДа, но будут пропускать другие изоформы. Молекулы сходного с СТГ строения (плацентарный СТГ, пролактин), а также СТГ-связывающий белок (с которым связано около 50% циркулирующего СТГ) могут вступать в перекрестные реакции и влиять на точность измерения. Также существуют различия и несогласованность в калибровках, что ограничивает возможности сравнения пороговых значений в разных исследованиях. Кроме того, лаборатории могут использовать разные единицы измерения концентрации либо активности СТГ [58].
Для борьбы с данными ограничениями в настоящее время предложен единый калибровочный стандарт для СТГ – 98/574. Все производители наборов должны уточнять определяемые изоформы, специфичность используемых антител и наличие перекрестных реакций с СТГ-связывающим белком [59].
Протеомные биомаркеры СТГ-дефицита
На момент подачи статьи публикации по протеомным биомаркерам СТГ-дефицита взрослых отсутствовали. В 2018 г. опубликованы результаты исследования, в котором методом протеомного анализа нового поколения SWATH-MS исследовались циркулирующие белки у детей с СТГ-дефицитом в сравнении со здоровыми добровольцами. Обнаружено три белка, которые могут являться биомаркерами для неинвазивной диагностики СТГ-дефицита у детей: аполипопротеин A-IV, CFHR4 (complement factor H-related protein 4) и PBP (platelet basic protein) [60]. Вопрос исследования данных белков при СТГ-дефиците у взрослых остается открытым.
Полиморфизмы рецептора гормона роста У человека ген рецептора гормона роста (r-СТГ) расположен на 5-й хромосоме. Ген состоит из девяти экзонов, кодирующих рецептор, и нескольких дополнительных экзонов в 5’ нетранслируемой области. Известны две основные изоформы r-СТГ, отличающиеся наличием (fl-GHR, full-length), либо отсутствием экзона 3 (d3-GHR, exon 3-deficient). Отсутствие экзона 3 приводит к потере 22 аминокислот во внеклеточном домене рецептора [61]. В настоящее время считается, что связывающая способность обеих изоформ одинакова. Изоформа d3 доминирует над fl, около 50% европейцев гетероили гомозиготны по d3 [62]. Носительство d3 ассоциировано с высоким ростом, более высокой чувствительностью к СТГ и является фактором долгожительства у мужчин [63].
У пациентов с генотипом fl/fl отмечался более выраженный ответ на введение соматропина после лечения в течение 1 нед, по сравнению с пациентами с аллелями d3 [64]. В другом исследовании с длительностью лечения 12 мес, повышение ИРФ-1 в ответ на терапию было достоверно большим в группе d3/d3. Различий по концентрации ИРФ-1 между группами fl/d3 и fl/fl не выявлено [65]. По данным S. Meyer и соавт., не выявлено достоверных различий концентрации ИРФ-1 на фоне терапии между носителями одного или двух аллелей d3 и генотипа fl/fl [66]. У взрослых пациентов с СТГ-дефицитом с аллелями d3 снижен риск переломов позвонков независимо от получения заместительной терапии СТГ [67].
Также опубликованы исследования, в которых между генотипами не обнаруживалось различий по клиническим проявлениям и нежелательным явлениям, качеству жизни, концентрациям ИРФ-1, составу тела и жировой массе [68–71].
Проведено два исследования, в которых оценивали влияние полиморфизмов r-СТГ на различные показатели на фоне заместительной терапии СТГ спустя 1 год и после 5 лет лечения. В исследовании Van der А. Klaauw и соавт. после первого года лечения в группе носителей d3 отмечалось более выраженное повышение ИФР-1 при одинаковых средних дозах соматотропина в группах. Среди носителей d3 общий холестерин снижался менее выраженно, а концентрация холестерина ЛПВП достигала более высоких значений по сравнению с fl/fl. Однако, через 5 лет данных различий между группами обнаружено не было [72]. По данным С. Giavoli и соавт., лечение соматропином нормализует концентрацию ИРФ-1 и снижает процентную долю жировой массы после 1 года и после 5 лет лечения, независимо от присутствия аллеля d3. После одного года лечения в группах носителей d3 отмечалось повышение концентрации холестерина ЛПВП, после пяти лет – снижение концентрации общего холестерина и холестерина ЛПНП.
При исходно одинаковой распространенности нарушений углеводного обмена через 5 лет после лечения в группе fl/fl она снизилась, а в группах носителей d3 двукратно увеличилась [73].
В настоящее время данные по влиянию полиморфизма r-СТГ на клиническую картину СТГ-дефицита взрослых малочисленны, а имеющиеся публикации по взаимоотношениям носительства аллели d3 и ответа на заместительную терапию противоречивы.
Лечение
Определение показаний к заместительной терапии Целесообразность заместительной терапии СТГ-дефицита взрослых определяется предполагаемой пользой для каждого конкретного пациента. С наибольшей вероятностью пользу от лечения будут получать пациенты с выраженным СТГ-дефицитом, подтвержденным с помощью стимуляционных проб и низкой сывороточной концентрацией ИРФ-1. Клиническими проявлениями, указывающими на необходимость лечения, являются остеопения, повышенный сердечно-сосудистый риск, а также сниженное качество жизни, которое необходимо подтвердить валидизированными опросниками для данного заболевания [74].
Важной категорией являются пациенты, достигшие целевого роста на фоне заместительной терапии и переходящие под наблюдение взрослого эндокринолога. У таких пациентов полное созревание костной и мышечной систем может продолжаться в течение последующих 10 лет [75–77]. На фоне отмены соматропина после достижения целевого роста отмечалось ухудшение показателей липидного обмена, состава тела и качества жизни [76, 78, 79]. После достижения конечного роста необходимо проводить редиагностику СТГ-дефицита, через 1–3 мес после
перерыва в лечении соматропином (табл. 4).

Негативные клинические проявления СТГ-дефицита и положительное действие заместительной терапии соматотропином распространяется и на пациентов старше 65 лет [80]. Несмотря на известный факт снижения секреции СТГ с возрастом, диагностические пробы позволяют разграничить физиологическое снижение от патологического, обусловленного СТГ-дефицитом [81].
Таким образом, к пожилым пациентам применяются те же критерии, что и к другим возрастным категориям. Однако, для таких пациентов необходимо выбирать более низкую стартовую дозировку, о чем подробнее будет написано ниже.
Начало лечения и подбор дозировок
Лечение СТГ-дефицита у взрослых рекомендуется начинать с низких доз (0,2-0,4 мг/сут подкожно), это позволяет снизить вероятность развития побочных эффектов [82]. Титровать дозу рекомендуется с интервалом 6–8 нед, в зависимости от клинического ответа и концентрации ИРФ-1, которую рекомендуется поддерживать в верхней половине референсного диапазона. У пациентов моложе 30 лет рекомендуется выбирать большую стартовую дозу (0,4–0,5 мг/сут), а у пожилых (старше 60 лет) – меньшую (0,1–0,2 мг/сут), чтобы минимизировать риск развития побочных эффектов, поскольку с возрастом отмечается физиологическое снижение потребности в соматотропине. Женщинам, получающим заместительную терапию пероральными эстроген-содержащими препаратами, требуется бо́льшая доза соматропина, поскольку пероральные препараты ингибируют синтез и секрецию ИРФ-1 печенью [83]. При применении трансдермальных форм эстрогенов коррекции доз соматотропина, как правило, не требуется.
После подбора стабильной дозировки анализ крови на ИРФ-1 и оценку на предмет побочных эффектов рекомендуется проводить каждые 6 мес, анализ липидного профиля и глюкозы плазмы натощак – каждые 12 мес или сразу после повышения дозы соматотропина. Физикальное обследование с измерением АД, веса, окружности талии и ИМТ рекомендуется проводить ежегодно и на каждом визите. Если по данным впервые проведенной рентгеновской денситометрии выявлено снижение МПК, повторное исследование проводится 1 раз в 2 года. Также для оценки качества жизни рекомендуется ежегодное заполнение соответствующих опросников.
Максимальная длительность лечения в настоящее время не определена. Однако в случае, если эффекта от лечения нет в течение 1 года, необходимо решить вопрос об отмене соматотропина [24].
Побочные эффекты
Основные побочные эффекты заместительной терапии обусловлены изменением имеющихся при СТГ-дефиците нарушений водно-электролитного обмена либо задержкой жидкости при передозировке препарата: артралгии, скованность суставов, миалгии, парестезии и периферические отеки. Такие побочные эффекты быстро регрессируют при снижении дозы соматотропина.
Поскольку ранее начальная доза подбиралась по массе тела, побочные эффекты встречались чаще, чем при титрации дозы начиная с минимальной.
К очень редким побочным эффектам относятся доброкачественная внутричерепная гипертензия (ДВГ) и макулярный отек. Распространенность ДВГ в популяции детей, получающих терапию соматотропином, приблизительно в 100 раз больше, чем в здоровой популяции [84]. В литературе есть только одно описание ДВГ как побочного эффекта заместительной терапии СТГ-дефицита у взрослого пациента [85]. Описано 2 случая макулярного отека у пациентов без сахарного диабета: у девочки 11 лет, получавшей терапию соматотропином по поводу синдрома Шерешевского–Тернера, и у взрослого пациента 31 года с травматическим повреждением гипоталамо-гипофизарной области. В обоих случаях побочный эффект развился на фоне увеличения дозы соматотропина [86].
Влияние на заместительную терапию других недостаточностей
СТГ ингибирует 11-β-гидроксистероиддегидрогеназу 1-го типа и способствует большему синтезу кортизона и снижению синтеза кортизола. Необходимо внимательное наблюдение за пациентами с надпочечниковой недостаточностью (НН) при начале лечения соматотропином, поскольку возможно развитие клинической картины НН и повышение риска декомпенсации даже при легких инфекционных заболеваниях [87]. Кроме того, у пациентов с субклиническим гипокортицизмом после начала терапии соматропином возможна манифестация клинических проявлений НН.
При назначении соматропина пациентам без вторичного гипотиреоза наблюдается снижение концентрации тироксина сыворотки (Т4), однако концентрация трийодтиронина (Т3) остается стабильной. Пациентам на заместительной терапии Т4 часто требуется увеличение доз. Предполагается, что СТГ может увеличивать периферическую конверсию Т4 в Т3 и при этом подавлять высвобождение ТТГ в гипофизе, однако точный механизм неизвестен [88, 89].
Чувствительность к СТГ снижена у пациенток, получающих пероральные эстрогенсодержащие препараты. Данное явление объясняется феноменом первого прохождения через печень и ингибированием продукции ИРФ-1. На фоне применения трансдермальных форм эстрогенов этот эффект практически отсутствует [90, 91].
Тестостерон стимулирует секрецию СТГ и усиливает его стимулирующее влияние на выработку ИРФ-1. Дигидроэпиандростерон (ДГЭА) потенцирует выработку ИРФ-1 – пациентки на терапии ДГЭА достигают целевых показателей ИРФ-1 на меньших дозах соматотропина. Механизм такого эффекта неизвестен. Поскольку ДГЭА метаболизируется до тестостерона, существует предположение, что именно увеличение концентрации сывороточного тестостерона объясняет этот эффект [92].
Онкологический риск
Согласно эпидемиологическим исследованиям, возможно, существует взаимосвязь между высоконормальной концентрацией СТГ и ИРФ-1 в крови и распространенностью онкологических заболеваний [93]. При акромегалии риск развития некоторых онкологических заболеваний выше, чем в общей популяции [94].
В настоящее время нет данных об увеличении частоты рецидивов вне- и внутричерепных новообразований у взрослых пациентов, получающих соматотропин по поводу СТГ-дефицита. При этом лечение соматотропином противопоказано при наличии ак-тивного онкологического заболевания [24]. В 2017 г. опубликовано исследование D. Olsson и соавт., в которое включены 426 пациентов с гормонально-неактивными аденомами: 207 получали соматотропин (медиана длительности лечения 12,2 г.), 219 не получали лечения соматотропином (медиана наблюдения 8,2 г.). Среди пациентов, получавших заместительную терапию, отмечено снижение общей смертности и не выявлено повышения частоты смертности от онкологических заболеваний [95].
По данным метаанализа, в котором проанализированы данные семи проспективных и двух ретроспективных исследований (n=11 191).
Заместительная терапия соматотропином связана со снижением онкологических рисков при СТГ-дефиците взрослых (относительный риск 0,69; 95% ДИ 0,59–0,82). Снижение риска сохранялось при дополнительных анализах по подгруппам, с исключением ретроспективных исследований, с количеством наблюдений менее 100, исследований среди пациентов с краниофарингиомами и исследований с длительностью наблюдения менее 3 лет [96].
Таким образом, согласно существующим данным, польза от заместительной терапии соматотропином у взрослых превышает теоретический риск новообразований. Скрининг на предмет новообразований у пациентов, получающих заместительную терапию соматотропином, не отличается от общей популяции. При этом стоит пристальнее наблюдать пациентов зрелого возраста, пациентов с онкологическим анамнезом и семейной предрасположенностью, а также группу с пациентов после лучевой терапии [97].
Качество жизни
Качество жизни взрослых пациентов с СТГ-дефицитом оценивается с помощью соответствующих опросников: QoL-AGHDA [98] и PGWB [99].
В 2012 г. опубликован метаанализ A. Hazem и соавт., в который включались данные рандомизированных плацебо-контролируемых исследований – всего 54 исследования (n=3400). Из отобранных исследований качество жизни оценивалось в 16, однако авторы не смогли провести метаанализ по причине гетерогенности данных и недостатка количественных данных. В 11 исследованиях отмечалось достоверное улучшение качества жизни согласно как минимум одному методу оценки [100].
Смертность
В исследовании по данным Голландского государственного регистра по лечению гормоном роста сравнили 2229 пациентов, получающих лечение соматотропином, с первой контрольной группой из 109 пациентов с СТГ-дефицитом, не получающих лечения, и второй контрольной группой из 356 пациентов после отмены соматотропина. Стандартизованный показатель смертности в группе лечения составил 1,27 (1,04–1,56) по отношению к общей популяции. После исключения из анализа пациентов с акромегалией и болезнью Иценко–Кушинга показатель составил 1,29 (1,05–1,59), после исключения пациентов высокого риска (краниофарингиомы или другие образования гипоталамо-гипофизарной области) – 1,00 (0,79–1,26). Также выявлено достоверное повышение стандартизованного показателя смертности среди женщин в группе лечения – 2,52 (1,57–4,06), и оно наблюдалось даже после исключения пациентов высокого риска.
Авторы отмечают, что это может быть связано с длительным течением некомпенсированного СТГ-дефицита, негативно повлиявшего на сердечно-сосудистый риск, однако данное предположение требует дальнейшего изучения [101].
В исследовании R. Gaillard и соавт. среди 13 983 пациентов с СТГ дефицитом, получающих соматропин (средний период наблюдения 4,9 года), отмечено повышение общей смертности на 13% в сравнении с общей популяцией (стандартизованный показатель смертности 1,13 (1,04–1,24)), при этом показатели смертности от сердечно-сосудистых и онкологических заболеваний не отличались [102]. По результатам метаанализа J. Pappachan и соавт., стандартизованный показатель смертности составил 2,40 [95% ДИ 1,46–3,34] у пациентов с СТГ дефицитом без лечения и 1,15 [95% ДИ 1,05–1,24] у пациентов, получающих соматотропин [103]. K. Stochholm и G. Johansson также продемонстрировали более низкую смертность среди получающих соматотропин пациентов по сравнению с пациентами без лечения: отношение рисков по смертности от всех причин 0,34 (95% ДИ 0,15–0,77) [104].
Метаболические эффекты заместительной терапии
Поскольку СТГ является одним из значимых регуляторов метаболизма и энергетического гомеостаза [105], лечение СТГ-дефицита у взрослых пациентов оказывает влияние на состав тела, липидный, углеводный и костно-минеральный обмены, что подтверждается данными метаанализов.
Состав тела. В мета-анализ А. Hazem и соавт. были включены 54 РКИ (n~3400). Лечение соматропином достоверно снижает массу тела (–2,31 кг, 95% ДИ –2,66– –1,96) и жировую массу (–2,56 кг, 95% ДИ –2,97– –1,3) и увеличивает тощую массу тела (1,38 кг, 95% ДИ 1,10–1,65). При этом достоверного влияния на минеральную плотность кости (МПК) выявлено не было, что может быть обусловлено малым количеством наблюдений [100].
В метаанализ C. Newman и соавт., целью которого было сравнить эффективность низких и более высоких доз соматропина в отношении влияния на состав тела и липидный обмен, включены результаты 22 РКИ (n=1153). Тощая масса тела достоверно увеличивалась в группах лечения по сравнению с плацебо, а жировая масса снижалась. Изменения тощей массы тела и жировой массы демонстрировали дозозависимый эффект – лечение более высокими дозами было эффективнее [106].
Сердечно-сосудистая система и липидный обмен. По данным метаанализа P. Maison и P. Chanson, в который были включены 16 исследований, компенсация СТГ-дефицита способствует увеличению массы левого желудочка, толщины межжелудочковой перегородки и задней стенки левого желудочка, увеличению диаметра левого желудочка в диастолу и ударного объема [107].
Известно, что толщина комплекса интима–медиа сонных артерий – предиктор прогрессирования ишемической болезни сердца [108].
Было показано, что лечение СТГ-дефицита приводит к снижению этого показателя [109]. В проведенных исследованиях продемонстрировано снижение общего холестерина сыворотки, практически полностью за счет снижения концентрации холестерина ЛПНП. Эффект более выражен у пациентов с исходно большими показателями общего холестерина, при этом степень снижения не зависит от факторов, связанных с ожирением. Согласно результатам метаанализа, проведенного P. Maison и соавт., лечение СТГ-дефицита приводило к достоверному снижению холестерина ЛПНП, общего холестерина, жировой массы, диастолического давления и увеличению тощей массы тела, концентраций глюкозы плазмы натощак и инсулина сыворотки [110]. В вышеупомянутом мета-анализе С. Newman и соавт. отмечено снижение общего холестерина и холестерина ЛПНП в группах лечения по сравнению с плацебо, но дозозависимого эффекта не выявлено [106]. Метаанализ V. Giagulli и соавт. также обнаружил достоверное снижение концентрации холестерина ЛПНП, однако не выявил достоверного действия на артериальное давление и снижение сердечно-сосудистого риска как при краткосрочной, так и при долгосрочной терапии соматотропином [111]. Среди пациентов, у которых на фоне лечения снижался холестерин ЛПНП, отмечено повышение концентрации сывороточного липопротеина (а), при этом данные остаются противоречивыми из-за различий в наборах по определению липопротеина (а).
Влияние этого явления на сердечно-сосудистый риск также неясно [112].
Углеводный обмен. В раздел метаанализа P. Maison и соавт., в котором анализировались показатели глюкозы и на фоне лечения, были включены данные 13 исследований (n=511): отмечено достоверное влияние заместительной терапии на тощаковые показатели глюкозы – [+0,43 (0,26; 0,60)]. Показатели оставались в пределах референсных значений как в группе лечения [5,1 ммоль/л (±0,5)], так и в группе плацебо [4,8 ммоль/л (±0,4)]. Концентрацию инсулина оценивали в 11 исследованиях (n=378): отмечено влияние заместительной терапии соматотропином на тощаковые показатели концентрации инсулина [+0,42 (0,23; 0,61)]. Средневзвешенное различие концентрации инсулина плазмы между группами лечения и плацебо составило 8,7 пмоль/л (7,0). Авторы заключают, что для надежных выводов по влиянию заместительной терапии соматропином на инсулинорезистентность необходимы исследования с прямым измерением чувствительности к инсулину [110].
В систематическом обзоре K. Stochholm и G. Johansson, опубликованном в 2015 г., оценены результаты 27 исследований – РКИ и открытых. Авторы отмечают, что данные по нарушениям углеводного обмена противоречивы: одни исследования отмечают повышенную встречаемость сахарного диабета (СД) на фоне лечения, по данным других – различий с популяционными данными нет. При этом исследования согласованно заключают, что риск развития СД на фоне заместительной терапии зависит от классических факторов риска, таких как ИМТ и возраст.
Авторы обзора делают вывод, что встречаемость СД среди пациентов на заместительной терапии соматотропином не повышена и зависит, скорее, от классических факторов риска СД [104].
В метаанализе V. Giagulli и соавт. отмечена дискордантность показателей гликемии, однако достоверного изменения показателей гликемии не выявлено. В тех случаях, когда отмечалось повышение гликемии, показатели всегда находились в пределах референсных значений и не достигали диагностических значений в ходе орального теста на толератность к глюкозе. Среди 10 исследований, в которых измерялся гликированный гемоглобин, только в 2 отмечалось его повышение, но и в данных исследованиях показатель никогда не превышал нормальных значений [111].
Костное ремоделирование и минеральная плотность кости. Лечение СТГ-дефицита у взрослых в третьей декаде жизни приводит к увеличению минеральной плотности костей (МПК) и способствует достижению пика костной массы [113]. При родолжении или возобновлении терапии соматотропином в течение 2 лет после закрытия зон роста у пациентов с СТГ-дефицитом, дебютировавшим в детстве, отмечается достоверное повышение МПК по сравнению с контрольной группой без лечения [76].
Прибавка МПК на фоне лечения наблюдается через 18–24 мес после начала лечения, составляет около 4–10%, более заметное увеличение отмечается в позвонках [114]. В проспективном исследовании с 18 пациентами с СТГ-дефицитом, получавшими лечение соматотропином в течение 7 лет, отмечено повышение МПК и сохранение показателей на фоне длительной терапии; однако, достоверного положительного влияния на микроархитектонику кости не выявлено [115]. В когорте из 230 взрослых пациентов с СТГ-дефицитом, получавших терапию соматропином, которых наблюдали в течение 15 лет, отмечено устойчивое повышение МПК в позвонках, более заметное среди мужчин, и стабилизация МПК в шейке бедра. В данном исследовании авторы сделали вывод, что частота переломов на фоне длительной терапии соматропином не увеличивается [116]. Согласно метаанализу P. Xue и соавт., в который вошло 20 исследований, существует достоверная взаимосвязь между лечением СТГ-дефицита и увеличением МПК в позвонках, шейке бедра и по данным total-body денситометрии. При этом корреляции между лечением и МПК в позвонках и totalbody не обнаружено в группах пациентов, получавших лечение фиксированными дозами соматотропина менее 2 лет. Также отмечены взаимосвязи лечения и total-body МПК при измерении на денситометрах Hologic и GE-Lunar.
Авторы заключают, что лечение СТГ-дефицита оказывает положительное влияние на МПК у взрослых, однако в некоторых когортах это влияние неочевидно [117]. В метаанализ M. Barake и соавт. включены данные 31 исследования. Заместительная терапия приводит к повышению МПК в поясничных позвонках и шейке бедра при лечении длительностью более 12 мес. При этом отсутствуют данные по влиянию заместительной терапии на риск переломов. Степень положительного влияния заместительной терапии СТГ-дефицита зависит от пола, возраста, дозы и длительности лечения [118].
Стоит отметить, что в указанных исследованиях не принималось во внимание потребление кальция, витамина D и антирезорбтивных препаратов, в связи с чем сделать однозначный вывод о положительвремени нет опубликованных данных РКИ, в которых бы оценивалось влияние лечения СТГ-дефицита у взрослых на частоту переломов.
Препараты СТГ длительного действия
В настоящее время на российском фармацевтическом рынке доступны препараты СТГ для ежедневного подкожного введения различных фирмпроизводителей, в том числе отечественных.
Депо-препарат LB03002 для еженедельного подкожного введения одобрен для лечения СТГ-дефицита у детей в Южной Корее. Также препарат был одобрен Европейским агентством лекарственных средств (EMA) в 2013 г. [121], однако в настоящее время разрешение отозвано, так как в течение 3 лет после одобрения препарат не поступил в продажу [122].
В настоящее время на разных стадиях исследований находятся препараты СТГ длительного действия: депо-формы, пегилированные препараты, пролекарства, СТГ, нековалентно связанный с альбумином, гибридные белки на основе СТГ [123]. Согласно обзору Общества исследований гормона роста, у каждого из препаратов свой профиль фармакокинетики и фармакодинамики, главными вопросами безопасности являются нефизиологическое повышение СТГ и ИРФ-1 и нефизиологическое тканевое распределение. Согласно данным, имеющимся в настоящее время, препараты длительного действия не вызывают тахифилаксию и проявляют клиническое действие, сравнимое с препаратами для ежедневного введения [124].
Заключение
СТГ-дефицит взрослых – системное полиэтиологическое заболевание, требующие соблюдения четких диагностических критериев для предотвращения гипердиагностики. В настоящее время из представленных провокационных проб в Российской Федерации доступны проба с инсулиновой гипогликемией и проба с глюкагоном, однако пороговые значения СТГ у последней окончательно не отработаны. Проба с глюкагоном представляется перспективной альтернативой пробе с инсулиновой гипогликемией; в настоящее время не опубликовано данных по сравнению данных проб на российской популяции пациентов.
Положительный эффект заместительной терапии соматотропином у взрослых пациентов с СТГ-дефицитом признается в отношении состава тела, физической активности, структуры костной ткани, липидного профиля и качества жизни, но влияние на смертность, риск переломов и сердечно-сосудистые риски остается недостаточно изученным. Существующие исследования ограничены отсутствием плацебо-контроля и малой длительностью наблюдения.
Кроме того, срок воздействия некомпенсированного СТГ-дефицита среди пациентов и, как следствие, его вклад в развитие коморбидностей могут различаться.
Перспективы развития заместительной терапии заключаются в создании препаратов пролонгированного действия, что позволит повысить приверженность пациентов лечению. Имеющиеся данные позволяют рассчитывать на сходный профиль эффективности и безопасности по сравнению с препаратами для ежедневного приема, что необходимо подтвердить в длительных проспективных исследованиях.
Дополнительная информация
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена при финансовой поддержке Российского научного фонда (проект № 19-15-00398).
Участие авторов: А.С. Луценко, Е.В. Нагаева, Т.С. Зенкова, О.С. Чухачева – сбор и анализ данных литературы, написание основного текста статьи; Ж.Е. Белая, Г.А. Мельниченко – редактирование текста статьи. Все авторы внесли значимый вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию до публикации.
Список литературы смотрите здесь.
Источник: Журнал «Проблемы эндокринологии» №5, 2019
Ссылка на оригинал: https://probl-endojournals.ru/probl/article/view/10322/9456